Nhóm halogen bao gồm những nguyên tố nào và chúng nằm ở vị trí nào trong bảng tuần hoàn các nguyên tố? Nêu tính chất hóa học của các nguyên tố halogen? Cùng Manta.edu.vn tìm hiểu chi tiết qua bài tổng hợp sau đây của Manta.edu.vn.
Nhóm halogen là gì? Vị trí của Nhóm halogen trong bảng tuần hoàn
Nhóm halogen còn thường được gọi là các nguyên tố halogen (tiếng Latinh có nghĩa là sản xuất muối).
Nhóm halogen gồm những phần tử nào? Trong Nhóm halogen bao gồm các nguyên tố flo (F), Br (brom), clo (Cl), iốt (I) và đạt (At) . Đặc biệt, Atatin không có trong tự nhiên, nó được điều chế nhân tạo trong các lò phản ứng hạt nhân nên được xem xét chủ yếu trong nhóm nguyên tố phóng xạ.
Nhóm halogen bao gồm các nguyên tố phi kim phản ứng tạo thành hợp chất có tính axit mạnh với hydro từ đó có thể tạo thành muối đơn giản (Theo Wikipedia).
Các halogen thuộc nhóm VIIA . Chúng đứng ở cuối chu kỳ , ngay trước các nguyên tố khí hiếm.
Cấu trúc phân tử của Nhóm halogen
Lớp electron ngoài cùng của các nguyên tố halogen đều có 7 electron , được chia thành 2 phân lớp p: phân lớp s có 2 electron, phân lớp p có 5 electron.
Do có 7 electron lớp ngoài cùng, chỉ thiếu 1 electron để đạt cấu hình khí hiếm nên ở trạng thái tự do hai nguyên tử halogen dùng chung một cặp electron tạo nên phân tử có liên kết cộng hóa trị không phân cực. (X -X hay X2, X là viết tắt của các nguyên tố halogen).
Liên kết của các phân tử X2 không bền, chúng thường bị tách thành 2 nguyên tử X. Trong các phản ứng hóa học, các nguyên tử này rất tích cực vì chúng dễ dàng nhận thêm một electron. Do đó, tính chất hóa học cơ bản của Nhóm halogen là chất oxi hóa mạnh.
Tính chất vật lý của Nhóm halogen
Hiểu được tính chất vật lí của halogen, chúng ta sẽ nắm được trạng thái, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi cũng như độ tan trong nước của chúng.

- Trạng thái và màu sắc: Thực ra trong Nhóm halogen, tính chất vật lý thay đổi có quy luật. Đi từ flo đến iot, ta thấy trạng thái tập hợp từ khí sang lỏng và rắn, có màu đậm hơn.
- Điểm nóng chảy và sôi: Nhiệt độ nóng chảy và sôi của Nhóm halogen tăng dần từ flo đến iốt.
- Độ tan trong nước: Flo không tan trong nước. Các nguyên tố Nhóm halogen còn lại ít tan trong nước, tan chủ yếu trong một số dung môi hữu cơ.
Đặc điểm chung của các nguyên tố Nhóm halogen được tóm tắt trong bảng dưới đây:
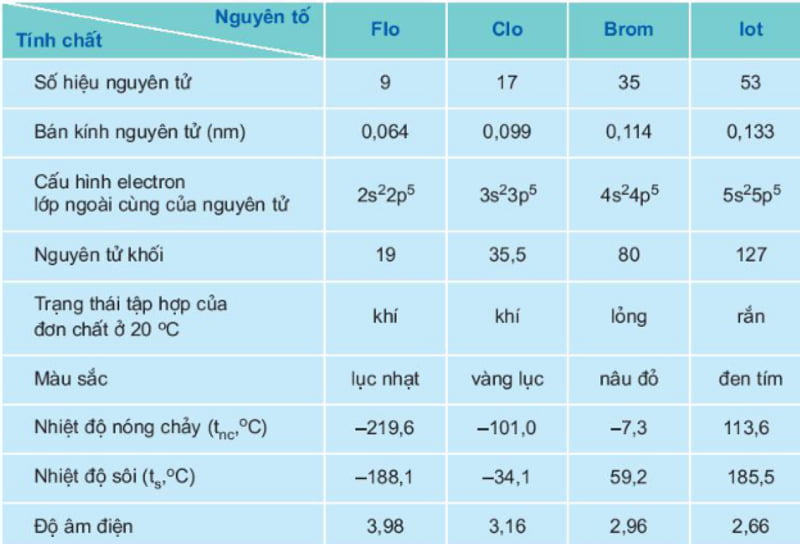
Tính chất hóa học của Nhóm halogen
Do lớp electron ngoài cùng có cấu tạo giống nhau nên các halogen tương đối giống nhau về tính chất hóa học cũng như thành phần và tính chất của hợp chất mà chúng tạo thành.
Tính chất halogen là phi kim điển hình , đi từ flo đến iot thì tính oxi hóa sẽ giảm dần.
Các halogen bị oxi hóa bởi hầu hết các kim loại để tạo thành muối halogenua, muối này oxi hóa khí hiđro để tạo thành hợp chất khí không màu là hiđro halogenua . Những khí này hòa tan trong nước và tạo thành dung dịch axit clohydric.

Các phản ứng quan trọng minh họa các tính chất của Nhóm halogen
Để giúp bạn đọc hiểu rõ hơn về tính chất hóa học của Nhóm halogen, chúng tôi sẽ đi vào chi tiết từng phản ứng minh họa cho từng tính chất đó, cụ thể:
Tác dụng với kim loại
Các nguyên tố Nhóm halogen phản ứng với hầu hết các kim loại, ngoại trừ Au và Pt, để tạo thành muối halogenua , thường xảy ra ở nhiệt độ cao. Muối tạo thành thường có hóa trị cao nhất của kim loại. Riêng phản ứng của nguyên tố halogen I2 với sắt (Fe) sẽ tạo ra sản phẩm là FeI2 (sắt hóa trị II).
2M + nX2 → 2MXn
Tác dụng với nước
Flo phản ứng mạnh với nước, brom và clo phản ứng thuận nghịch với nước nhưng Iốt không có bất kỳ phản ứng nào với nước. Ta có các phương trình phản ứng sau:
- 2H2O + 2F2 → 4HF + O2
- H2O + Cl2 HCl + HClO
- H2O + Br2 HBrO + HBr
Phản ứng với dung dịch kiềm
Một số nguyên tố Nhóm halogen có khả năng phản ứng với dung dịch kiềm loãng nguội và dung dịch kiềm đặc nóng. Các phương trình phản ứng điển hình như sau:
-
Với dung dịch kiềm loãng lạnh:
- X2 + 2NaOH → NaX + NaXO + H2O
- Cl2 + 2NaOH → NaCl + NaClO + H2O
- Dung dịch 2Cl2 + 2Ca(OH)2 → CaCl2 + Ca(ClO)2 + 2H2O
- Bột Cl2 + Ca(OH)2 → CaOCl2 + H2O
-
Riêng flo có phản ứng sau:
2F2 + 2NaOH → 2NaF + H2O + OF2
-
Với dung dịch kiềm đậm đặc nóng:
-
- 3X2 + 6KOH → 5KX + KXO3 + 3H2O
- 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O (1000C)
Phản ứng với muối halogenua
Các nguyên tố halogen (trừ flo – F2) có thể phản ứng với muối halogenua tạo thành muối mới và halogen mới.
X2 + 2NaX’ → 2NaX + X’2
(X’ là halogen có tính oxi hóa yếu hơn halogen X’)
Br2 + 2NaI → 2NaBr + I2
Phản ứng với hydro
Halogen phản ứng với hiđro tạo thành hiđro halogenua.
Ví dụ: H2 + X2 → 2HX
Điều kiện phản ứng của từng nguyên tố halogen như sau:
-
Với flo (F2): Phản ứng ngay cả trong bóng tối.
-
Với iot (I2): Phản ứng xảy ra thuận nghịch và phải đun nóng.
-
Với nước brom (Br2): Phản ứng xảy ra trong điều kiện đun nóng ở nhiệt độ cao.
-
Với clo (Cl2): Phản ứng xảy ra khi được chiếu sáng.
Phương trình lập một số số nguyên tố trong Nhóm halogen
Mỗi nguyên tử trong nhóm halogen có cách điều chế khác nhau. Một số phương trình điều chế điển hình cho từng phần tử là:
điều chế flo
Phương pháp duy nhất để sản xuất flo trong công nghiệp là điện phân hỗn hợp KF và HF (hỗn hợp lỏng), cực dương bằng than chì (graphite) và cực âm bằng thép hoặc đồng đặc biệt. ở cực âm có khí H2 và ở cực dương có khí F2.
2HF (điện phân nóng chảy+KF) → H2 + F2
điều chế clo
Để điều chế clo trong phòng thí nghiệm, người ta cho axit clohiđric đặc tác dụng với chất oxi hóa mạnh (có thể là MnO2 rắn hoặc KMnO4 rắn). Trong trường hợp điều chế clo từ MnO2 thì cần có xúc tác nhiệt độ, còn KMnO4 có thể đun nóng hoặc không. Khí clo thu được dễ lẫn khí hiđro clorua và hơi nước nên để điều chế khí clo tinh khiết ta tiếp tục dẫn qua bình rửa khí chứa dung dịch NaCl để giữ lại HCl và chứa axit sunfuric đặc để giữ lại. hơi nước.
- MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
- 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 6H2O
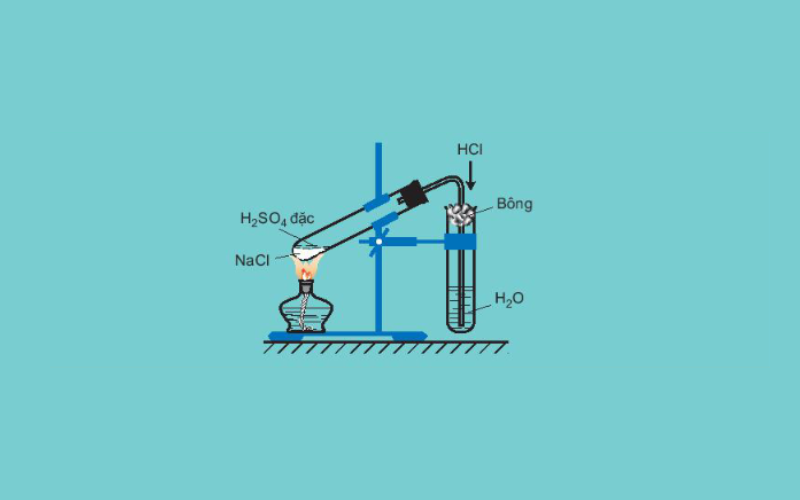
Trong công nghiệp, người ta điều chế khí clo bằng cách điện phân nóng chảy muối natri clorua hoặc điện phân dung dịch muối ăn có màng ngăn.
- 2NaCl → 2Na + Cl2
- 2NaCl + 2H2O → H2 + 2NaOH + Cl2
Điều chế brom
Về mặt công nghiệp, brom được sản xuất từ nước biển. Sau khi tách Nacl ra khỏi nước biển, dung dịch còn lại đã hòa tan NaBr. Tiếp tục dùng khí clo oxi hóa NaBr tạo Br2.
2NaBr + Cl2 → 2NaCl + Br2
điều chế iot
Trong công nghiệp, iot sẽ được điều chế từ rong biển. Cho dung dịch phản ứng với tác nhân oxi hóa để oxi hóa I- thành I2 .
2NaI + Cl2 -> 2NaCl + I2
Ứng dụng của Nhóm halogen trong cuộc sống
Nhóm halogen có nhiều phần tử khác nhau và mỗi phần tử đều có những ứng dụng nhất định trong đời sống. Sau đây là một số ứng dụng của một số nguyên tố halogen do Manta.edu.vn tổng hợp để các bạn tham khảo:

| Nguyên tố | Ứng dụng |
| Clo |
|
| Flo |
|
| Brom |
|
| Iot |
|
Bài tập Nhóm halogen SGK Hóa học lớp 10 có lời giải
Dựa vào những kiến thức lý thuyết về Nhóm halogen trên, các em có thể tự tin làm các bài tập trong sgk để củng cố lại kiến thức đã học.

Bài tập 1 (SGK Hóa học 10, trang 96)
Kim loại nào sau đây phản ứng với dung dịch HCl loãng và phản ứng với khí Cl2 đều cho muối clorua của kim loại giống nhau?
A. Fe
B. Zn
C.Cừ
D. Ag
Câu trả lời gợi ý:
- Kim loại Zn tác dụng với dung dịch HCl loãng và với khí clo đều cho cùng một muối clorua kim loại.
Zn + 2HCl → ZnCl2 + H2.
Zn + Cl2 → ZnCl2.
- Kim loại sắt phản ứng với HCl loãng và khí clo tạo ra 2 muối clorua khác nhau là FeCl2 và FeCl3.
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Ag, Cu không phản ứng với dung dịch HCl.
Bài tập 2 (SGK Hóa học 10, trang 96)
Tính chất nào sau đây không phải là tính chất của các halogen (F, Cl, Br, I)?
-
Nguyên tử chỉ có thể nhận thêm 1 electron.
-
Tạo với hiđro hợp chất có liên kết cộng hóa trị có cực.
-
Có số oxi hóa -1 trong mọi hợp chất.
-
Lớp electron ngoài cùng của nguyên tử có 7 electron.
Câu trả lời gợi ý:
Đáp án là: C. Trong tất cả các hợp chất F chỉ có số oxi hóa -1 vì F có độ âm điện lớn nhất. Các nguyên tố halogen khác ngoài số oxi hóa -1 còn có số oxi hóa +1; +3; +5; +7
Bài tập 3 (SGK Hóa học 10, trang 96)
Tính chất nào sau đây là đặc điểm chung của các halogen (F2, Cl2, Br2, I2):
-
Ở điều kiện thường nó là chất khí.
-
Chất oxi hóa mạnh.
-
Vừa có tính oxi hóa vừa có tính khử.
-
Tác dụng mạnh với nước
Câu trả lời gợi ý:
Đáp án đúng là B. Nhóm halogen là chất oxi hóa mạnh.
Bài 4 (trang 96 SGK Hóa học 10):
So sánh các halogen về các điều sau đây:
a) Cấu tạo nguyên tử và cấu tạo phân tử.
b) Tính chất vật lý.
c) Tính chất hóa học.
Câu trả lời gợi ý:
So sánh các nguyên tố halogen:
|
đặc điểm so sánh |
Giống nhau |
Sự khác biệt |
|
Cấu trúc nguyên tử và cấu trúc phân tử |
Số electron lớp ngoài cùng có 7e. Ở trạng thái cơ bản, mỗi nguyên tử halogen đều có một electron độc thân. Phân tử 2 nguyên tử, liên kết cộng hoá trị không phân cực. Cấu hình electron lớp ngoài cùng ns2np5 |
Bán kính nguyên tử tăng dần từ flo đến iot. Lớp ngoài cùng của nguyên tố flo là lớp thứ hai, vì vậy không có phân lớp d. Các nguyên tử clo, brom và iốt có phân lớp d rỗng. Ở trạng thái kích thích, nguyên tử clo, brom hoặc iốt có thể có 3, 5 hoặc electron đơn độc. Độ âm điện giảm dần từ flo đến iot |
|
Tính chất vật lý |
Trong Nhóm halogen, tính chất vật lí biến đổi theo quy luật: trạng thái đông tụ, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi… |
Trạng thái, màu sắc: Đi từ flo đến iot là trạng thái tập hợp từ khí sang lỏng rồi rắn, có màu đậm dần. Điểm nóng chảy và sôi: Tăng dần từ flo đến iot. Độ tan trong nước: Flo không tan trong nước. Các nguyên tố Nhóm halogen còn lại ít tan trong nước, tan chủ yếu trong một số dung môi hữu cơ. |
|
Tính chất hóa học |
Giống nhau về tính chất hoá học của nguyên tố cũng như về thành phần và tính chất của các hợp chất. Oxi hóa hầu hết kim loại tạo muối halogenua |
Khả năng oxi hóa của các halogen giảm dần từ flo đến iot. Phản ứng với kim loại, với hiđro, với nước của các halogen cũng khác nhau. |
Bài tập tính chất hóa học của halogen dành cho học sinh tự luyện
Ngoài các bài tập trong SGK Hóa học 10, dưới đây là một số bài tập Nhóm halogen ngoài SGK để các em tự vận dụng, luyện tập:
Câu 1. Axit có những tính chất hóa học cơ bản nào?
A. Tác dụng ánh kim.
B. Phản ứng với bazơ.
C. Phản ứng với oxit bazơ.
D. Cả A, B, C đều đúng.
Câu 2. Ứng dụng nào sau đây không phải của axit clohiđric?
A. Dùng để điều chế muối clorua.
B. Làm sạch bề mặt kim loại trước khi hàn.
C. Dùng trong chế biến thực phẩm và dược phẩm.
D. Dùng làm chất tẩy rửa.
Câu 3. Dd HCl có thể phản ứng với các hợp chất sau:
A.Cu,AgNO3. B.Al,AgNO3.
C. Ag, AgNO3. D. Al, Ba(NO3)2.
Câu 4. Chỉ dùng quỳ tím có thể nhận biết được các hoá chất nào sau đây: (ở dạng dd)
A. NaCl, BaCl2, HCl. B. AgNO3, NaOH, KCl.
C. HCl, KOH, NaCl. D. HCl, H2SO4, NaOH.
Câu 5. Thể tích dung dịch HCl 2M cần dùng để hòa tan 16g CuO là:
A. 100ml B. 200ml C. 500ml D. 400ml
Câu 6. Dãy oxit nào sau đây đều phản ứng được với dd HCl
A. CuO, ZnO, Na2O B. MgO, CO2, FeO
C. NO, CaO, Al2O3 D. Fe2O3, CO, CO2
Câu 7. Muối NaCl chủ yếu tồn tại ở dạng nào?
A. Nước biển và muối mỏ.
B. Trong cơ thể con người.
C. Trong lòng đất.
D. Có nhiều trong thực vật.
Câu 8. Tại sao không thu khí clo qua nước?
A. Vì clo dễ tan trong nước.
B. Vì clo nặng hơn nước.
C. Vì clo độc.
D. Vì clo nặng hơn không khí.
Câu 9. Khí clo có những tính chất vật lý nào?
A. Là chất khí, màu vàng lục, mùi hắc, nặng hơn không khí 2,5 lần, tan nhiều trong nước, clo là chất khí độc.
B. Khí có mùi trứng thối.
C. Là chất khí độc, ít tan trong nước.
D. Là chất khí không màu, tan nhiều trong nước.
Câu 10. Clo có tất cả các tính chất của một phi kim điển hình. Đúng hay sai?
Câu 11 . Clo được sử dụng để làm gì?
A. Khử trùng nước sinh hoạt.
B. Tẩy trắng vải vóc, bột giấy.
C. Điều chế nước giaven, hợp chất hữu cơ.
D. Cả A, B, C đều đúng.
Câu 12. Liên kết cộng hóa trị không phân cực?
A. Liên kết kém bền.
B. Liên kết bền vững.
C. Liên kết rất kém bền.
D. Liên kết rất bền.
Câu 13. Đại lượng nào sau đây không biến đổi tuần hoàn theo chu kỳ và theo nhóm?
A. Độ âm điện
B. Khối lượng nguyên tử
C. Năng lượng ion hóa
D. Bán kính nguyên tử
Câu 14. Các chất: H2SO4, HCl, O3, CO2. Có bao nhiêu chất có cấu trúc cho và nhận?
MỘT.1
B. 3
C. 4
mất 2
Câu 15. Dãy gồm các ion X+, Y- và nguyên tử Z đều có cấu hình electron 1s22s22p6 là:
A. Li+, F-, Nê. C. Na+, Cl-, Ar.
B. Na+, F-, Ne. D. K+, Cl-, Ar.
Câu 16: Điện phân nóng chảy 11,7 gam muối halogenua NaX, người ta thu được 2,24 lít khí (đkc).
a) Xác định nguyên tố X ?
b) Tính thể tích khí HX thu được khi cho X phản ứng với 4,48 lít H2 ở đtc ?
c) Tính thành phần % các khí sau phản ứng?
Câu 17: Đốt cháy 12,87 g NaCl với H2SO4 đặc thì thu được bao nhiêu lít khí ở đtc và bao nhiêu gam muối Na2SO4, biết hiệu suất phản ứng là H= 90%.
Câu 18: Cho 31,6 g KMnO4 phản ứng với dung dịch HCl dư thì thu được bao nhiêu lít Cl2 (ở dtc) nếu H của phản ứng là 75%.
Câu 19: Cho 0,896 lít Cl2 phản ứng hết với 200 ml dung dịch NaOH 1M, dư thu được dung dịch X. Tính CM của các chất trong dung dịch X?
Câu 20: Hiđro clorua bị oxi hóa bởi MnO2 biết rằng khí clo tạo thành trong phản ứng đó có thể đẩy 12,7 gam iot ra khỏi dung dịch natri iođua. Khối lượng HCl là bao nhiêu?
Hy vọng với những thông tin trên, bạn đã hiểu rõ hơn về Nhóm halogen là gì cũng như những đặc tính và ứng dụng tiêu biểu của nó. Hãy tiếp tục theo dõi chuyên mục Kiến thức cơ bản của Manta.edu.vn để cập nhật thêm nhiều thông tin thú vị mỗi ngày. Chia sẻ nếu bạn thấy phần tổng hợp trên của Manta.edu.vn hữu ích nhé!



