Muối cacbonat được chia thành các lớp khác nhau với các tính chất và ứng dụng cụ thể. Cùng Manta.edu.vn tìm hiểu kỹ hơn về loại muối này và giải các bài tập trong SGK qua bài viết dưới đây.
Nêu khái niệm muối cacbonat?
Muối cacbonat là muối của axit cacbonic nó gồm 2 loại nhỏ là muối cacbonat CO32- và muối hiđrocacbonat HCO3-. Muối cacbonat rất phổ biến và có nhiều ứng dụng trong đời sống như làm nguyên liệu sản xuất vôi, xi măng, xà phòng, thuốc chữa bệnh, v.v.

Phân loại muối cacbonat
Muối cacbonat được phân thành 2 loại chính gồm muối cacbonat trung tính và muối cacbonat axit.
-
Muối cacbonat trung hòa: Được gọi là muối cacbonat không còn nguyên tố H trong thành phần axit – bazơ. Ví dụ: Magiê cacbonat (MgCO3), canxi cacbonat (CaCO3), natri cacbonat (Na2CO3)…
-
Muối cacbonat của axit: Người ta gọi là muối hiđrocacbonat, nghĩa là trong gốc axit có chứa nguyên tố H. Ví dụ: Natri bicacbonat NaHCO3; canxi bicacbonat (Ca(HCO3)2, kali bicacbonat (KHCO3)…
Độ tan của muối cacbonat
Hầu hết các muối cacbonat đều không tan trong nước, trừ một số muối cacbonat của kim loại kiềm như Na2CO3, K2CO3,… Ngược lại, hầu hết các muối hiđrocacbonat đều tan trong nước như Mg(HCO3)2, Ca(HCO3)2…
Tính chất hoá học của muối cacbonat
Muối cacbonat có những tính chất hóa học đặc trưng như phản ứng với dung dịch axit mạnh, phản ứng với dung dịch bazơ, phản ứng với dung dịch muối, dễ bị nhiệt phân hủy giải phóng khí CO2 (trừ Na2CO3, K2CO3…). Đặc biệt:

Muối cacbonat phản ứng với axit
Muối cacbonat có khả năng phản ứng với axit mạnh hơn axit cacbonic tạo thành muối mới và giải phóng khí CO2.
Để chứng minh tính chất hóa học này của muối cacbonat, SGK Hóa học 9 nêu các thí nghiệm cụ thể lần lượt cho dung dịch NaHCO3 và Na2CO3 phản ứng với dung dịch axit clohiđric (HCl). Quan sát thí nghiệm ta thấy ở cả 2 ống nghiệm đều có hiện tượng bọt khí thoát ra. Điều này xảy ra do một phản ứng hóa học:
NaHCO3 (dd) + HCl (dd) -> NaCl (dd) + H2O (l) + CO2 (k)
Na2CO3 (dd) + 2HCl (dd) -> 2NaCl (dd) + H2O(l) + CO2 (k)
Phản ứng với dung dịch bazơ
Một số dung dịch muối cacbonat phản ứng với dung dịch bazơ tạo thành muối cacbonat không tan và bazơ mới
Ví dụ:
K2CO3 (dd) + Ca(OH)2 (dd) -> CaCO3 (rắn – trắng) + 2KOH (dd)
Lưu ý: Muối hiđrocacbonat phản ứng với dung dịch kiềm tạo thành muối trung hòa và nước.
Ví dụ:
NaHCO3 (đ) + NaOH (đ) -> Na2CO3 (đ) + H2O (l)
Phản ứng với dung dịch muối
Dung dịch muối cacbonat có thể phản ứng với một số dung dịch muối khác tạo ra 2 muối mới.
Ví dụ: Làm thí nghiệm cho dung dịch natri cacbonat (Na2CO3) phản ứng với dung dịch canxi clorua (CaCl2), xuất hiện kết tủa đục hoặc trắng. Ta có phương trình phản ứng sau:
Na2CO3 (dd) + CaCl2 (dd) -> CaCO3 (rắn – trắng) + 2NaCl (dd)
Phản ứng phân hủy muối cacbonat
Nhiều muối cacbonat, trừ muối cacbonat trung hòa của kim loại kiềm, dễ bị nhiệt phân hủy, giải phóng khí cacbonic. Ví dụ:
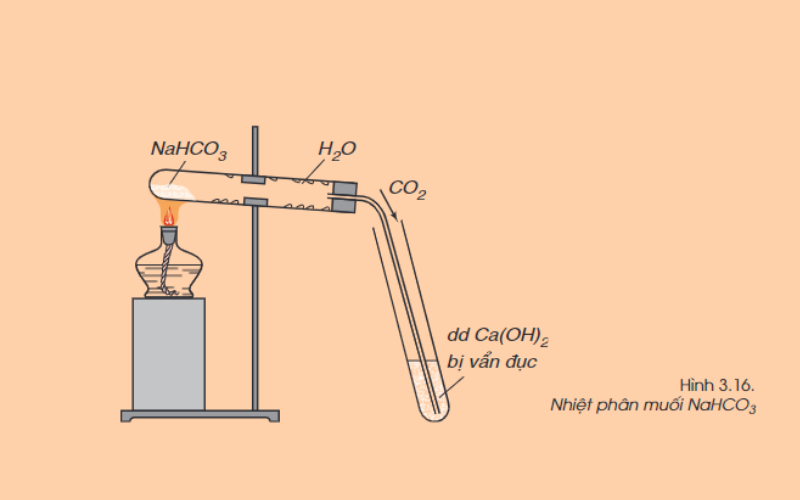
CaCO3(r) -> nhiệt độ CaO(r) + CO2(k)
2NaHCO3 (r) -> nhiệt độ Na2CO3 (r) + H2O (h) + CO2 (k)
Ứng dụng của muối cacbonat trong đời sống và sản xuất
Muối cacbonat có nhiều ứng dụng trong đời sống thực tiễn cũng như trong sản xuất công nghiệp. Mỗi loại muối cacbonat cụ thể đều có những ứng dụng riêng:

| Tên muối | Ứng dụng |
| CaCO3 (canxi cacbonat) | Ứng dụng trong công nghiệp xây dựng như cẩm thạch, đá xây dựng, thành phần cấu thành của xi măng.
Ứng dụng trong ngành sơn, canxi cacbonat được sử dụng như chất độn chính. Ứng dụng làm tấm trần, khung nhựa, ống PVC… |
| Na2CO3 (natri cacbonat) | Nguyên liệu sản xuất thủy tinh (chiếm 13-15%)
Làm chất phụ gia trong xà phòng, chất tẩy rửa. Nguyên liệu cho nhiều sản phẩm hóa chất gốc natri. |
| NaHCO3 (natri bicarbonat – baking soda) | Tạo độ giòn, xốp và làm đẹp cho bánh.
Tạo bọt và tăng PH trong một số loại thuốc như thuốc nhức đầu. Giải quyết các vấn đề răng miệng như phòng ngừa sâu răng, mòn răng, bệnh nha chu… Ứng dụng làm các chế phẩm trung hòa acid dịch vị chữa bệnh trào ngược dạ dày… |
Bài tập về muối cacbonat SGK Hóa học 9 có lời giải
Một số bài tập về muối cacbonat dành cho các bạn ôn tập kiến thức lý thuyết và vận dụng thực hành:

Bài tập 2 SGK Hóa học 9 trang 91
Dựa vào tính chất hóa học của muối cacbonat, hãy nêu tính chất của muối MgCO3 và viết các phương trình hóa học minh họa.
Câu trả lời gợi ý:
MgCO3 có tính chất của muối cacbonat.
-
Phản ứng với dung dịch axit:
MgCO3 + H2SO4 → MgSO4 + CO2↑ + H2O.
-
MgCO3 không tan trong nước, không phản ứng với dung dịch muối và dung dịch bazơ.
-
Dễ dàng phân hủy:
MgCO3 -> (nhiệt độ) MgO + CO2.
Bài tập 3 SGK Hóa học 9 trang 91
Viết các phương trình hóa học của các chuyển hóa sau:
C -> CO2 -> CaCO3 -> CO2
Câu trả lời gợi ý:
phương trình hóa học:
(1) C + O2 ->(nhiệt độ) CO2
(2) CO2 + Ca(OH)2 → CaCO3 + H2O
(3) CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Bài tập 4 SGK Hóa học 9 trang 91
Cho biết cặp chất nào sau đây có thể phản ứng với nhau.
a) H2SO4 và KHCO3; b) K2CO3 và NaCl; c) MgCO3 và HCl; đ) CaCl2 và Na2CO3; e) Ba(OH)2 và K2CO3
Giải thích và viết phương trình hóa học.
Câu trả lời gợi ý:
Những cặp chất phản ứng được với nhau là cặp chất a, c, d và e. Phương trình hóa học như sau:
H2SO4 + 2KHCO3 → K2SO4 + 2CO2 + 2H2O
MgCO3 + 2HCl → MgCl2 + CO2 + H2O
CaCl2 + Na2CO3 → CaCO3 + 2NaCl
Ba(OH)2 + K2CO3 → BaCO3 + 2KOH
Những cặp chất không phản ứng với nhau: b).
Chú ý: Điều kiện xảy ra phản ứng trao đổi trong dung dịch chỉ khi sản phẩm tạo thành có kết tủa (không tan) hoặc có khí tạo thành.
Bài tập 5 SGK Hóa học 9 trang 91
Tính thể tích khí CO2 (dktc) tạo thành để dập tắt đám cháy nếu trong bình chữa cháy có dung dịch chứa 980g H2SO4 tác dụng hết với dung dịch NaHCO3.
Câu trả lời gợi ý:
Phương trình hóa học của phản ứng:
2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 + 2H2O
Như vậy: nCO2 = 2 x nH2SO4 = 10 x 2 = 20 mol.
VCO2 = nx 22,4 = 20 x 22,4 = 448 lít.
Trên đây là tổng hợp toàn bộ kiến thức lý thuyết về muối cacbonat và gợi ý cách giải một số bài tập trong SGK để bạn đọc tham khảo. Hãy thường xuyên truy cập website Manta.edu.vn để tham khảo thêm nhiều kiến thức môn học hay và đừng quên chia sẻ nếu thấy bài viết hữu ích nhé!



