Axit photphoric (H3P04) là một hóa chất độc hại đóng vai trò quan trọng trong nhiều ngành sản xuất, đặc biệt là sản xuất phân bón và thuốc bảo vệ thực vật. Bạn biết gì về hóa chất này? Hãy cùng Manta.edu.vn tìm hiểu những thông tin quan trọng về axit photphoric trong bài viết dưới đây!
Định nghĩa axit photphoric là gì?
Định nghĩa : Axit photphoric còn được gọi với các tên gọi khác như: Axit trihydroxodioxidophotphoric, axit photphoric, axit orthophotphoric.
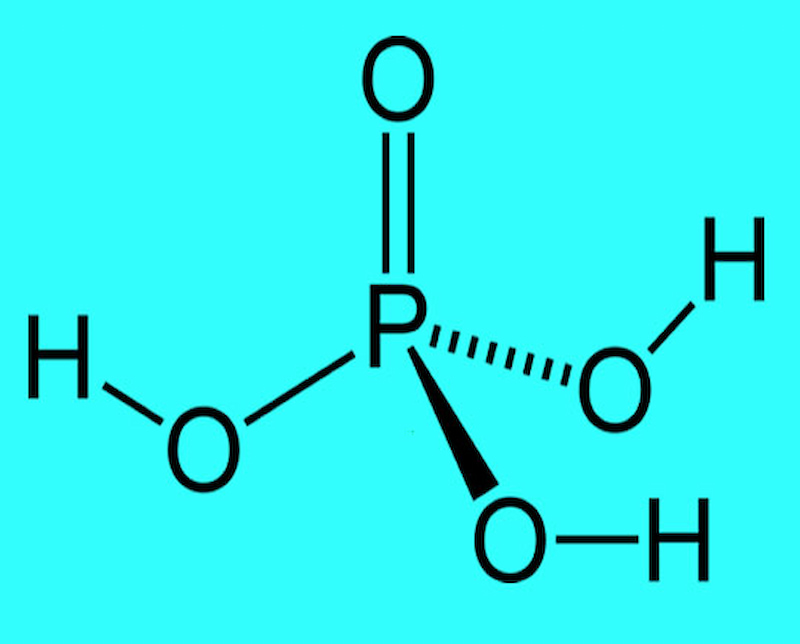
Công thức hóa học : H3PO4.
Cấu tạo phân tử : Axit photphoric có 3 giai đoạn phân ly. Cấu trúc phân tử của axit này bao gồm 3 phân tử hydro liên kết với phân tử PO4.
Tính chất vật lý của axit photphoric
Axit photphoric là chất kết tinh trong suốt, tồn tại ở hai dạng: chất rắn kết tinh không màu (tan vô hạn trong nước hoặc rượu có cấu trúc tứ diện đều) và chất lỏng trong suốt (không màu, có vị chua). Thông thường, axit photphoric được sử dụng dưới dạng dung dịch đặc, nhớt, không màu ở nồng độ 85%.
-
Axit photphoric là axit ưa nước , dễ tan, tan vô hạn trong nước theo bất kỳ tỉ lệ nào.
-
Nhiệt độ nóng chảy : 42.5 độ C
-
Nhiệt độ phân hủy : 213 độ C.
-
Mật độ : 1,87 g/cm3
Tính chất hóa học của axit photphoric
Dưới đây là những tính chất hóa học đặc trưng của axit photphoric mà các em cần nhớ.

Phân ly thuận nghịch theo 3 bước trong dung dịch
Axit photphoric là một axit ba có độ bền trung bình. Trong dung dịch nước, H3PO4 sẽ phân ly thuận nghịch theo 3 bước như sau:
-
Bước 1 : H3PO4 H+ + H2PO4- (Phân ly chính)
-
Bước 2 : H2PO4- ↔ H+ + HPO4(2-) (Phân ly kém)
-
Bước 3 : HPO4(2-) ↔ H+ + PO4(3-) (Phân ly rất yếu)
Như vậy trong dung dịch axit photphoric có các ion H+, H2PO4-, HPO4(2-), PO4(3-) và các phân tử H3PO4 không phân ly.
Axit photphoric có tất cả các tính chất của một axit
Axit photphoric có tất cả các tính chất hóa học của axit, gồm:
-
Làm quỳ tím hóa đỏ .
-
Tác dụng với oxit bazơ , sản phẩm là muối và nước:
2H3PO4 + 3Na2O → 2Na3PO4 + 3H2O
-
Phản ứng với bazơ tạo ra muối và nước (các sản phẩm của muối thay đổi tùy theo tốc độ phản ứng, chẳng hạn như muối axit, muối trung hòa hoặc hỗn hợp các muối đó).
Ví dụ:
KOH + H3PO4 → KH2PO4 + H2O
2KOH + H3PO4 → K2HPO4 + 2H2O
3KOH + H3PO4 → K3PO4 + 3H2O
-
Tác dụng với kim loại đứng trước H2 , tạo sản phẩm muối và giải phóng H2:
Ví dụ: 2H3PO4 + 3Mg → Mg3(PO4)2 + 3H2
-
Phản ứng với muối tạo muối mới + axit mới:
Ví dụ: H3PO4 + 3AgNO3 → 3HNO3 + Ag3PO4
-
Phản ứng nhiệt phân : Ở nhiệt độ 200-250°C và 400-500°C, axit photphoric thể hiện tính oxi hóa – khử khi xảy ra phản ứng nhiệt phân.
2H3PO4 → H4P2O7 + H2O (nhiệt độ từ 200 đến 250 độ C)
H4P2O7 → 2HPO3 + H2O (nhiệt độ từ 400 đến 500 độ C)
Cách điều chế axit photphoric?
Với những ứng dụng quan trọng trong các ngành sản xuất, axit photphoric được điều chế như thế nào? Hãy cùng Manta.edu.vn tìm hiểu cách điều chế loại axit này trong phòng thí nghiệm và trong công nghiệp.

Điều chế axit photphoric trong phòng thí nghiệm
Trong phòng thí nghiệm, axit photphoric được điều chế bằng cách dùng axit nitric đặc HNO3 oxi hóa photpho ở nhiệt độ cao:
P + 5HNO3 (rắn) → H3PO4 + 5NO2 + H2O (nhiệt độ)
Sản xuất công nghiệp axit photphoric
Trong công nghiệp, axit photphoric được sản xuất theo hai phương pháp: phương pháp khô và phương pháp ướt.
-
Phương pháp ướt (phương pháp chiết)
Dưới đây là cách sử dụng axit sunfuric đậm đặc trên quặng phốt phát hoặc apatit :
Ca3(PO4)2 + 3H2SO4 (đậm đặc) → 3CaSO4 (kết tủa) + 2H3PO4 (nhiệt độ)
H3PO4 được tạo thành sau đó được tách ra khỏi kết tủa bằng cách lọc và cô đặc. Tuy nhiên, axit H3PO4 thu được bằng phương pháp này không tinh khiết. Để thu được axit tinh khiết có nồng độ cao hơn người ta thường dùng phương pháp khô.
-
Phương pháp khô (quy trình nhiệt)
Người ta đốt cháy photpho để tạo thành photpho pentaoxit P2O5, sau đó cho P2O5 tiếp tục phản ứng với nước , sản phẩm thu được là H3PO4 tinh khiết.
P → P2O5 → H3PO4
4P + 5O2 → 2P2O5 (nhiệt độ)
P2O5 + 3H2O → 2H3PO4
Những ứng dụng nổi bật của axit photphoric
Sau khi nắm được cấu tạo, tính chất lý hóa và phương pháp điều chế axit photphoric , trong phần này chúng ta sẽ tìm hiểu những ứng dụng nổi bật của H3PO4 trong thực tế.

Ứng dụng của axit photphoric trong nông nghiệp
Trong nông nghiệp, một lượng lớn axit photphoric được sử dụng để sản xuất phân bón. H3PO4 đậm đặc có thể chứa tới 70%-75% P2O5 – nguyên liệu cực kỳ quan trọng trong điều chế muối photphat, sản xuất phân lân, hợp chất photpho (trong thuốc trừ sâu), thức ăn gia súc,…
Ứng dụng của axit photphoric trong công nghiệp
Axit photphoric đóng góp quan trọng trong công nghiệp với các ứng dụng tiêu biểu như:
-
Chất phụ gia : Axit photphoric là chất phụ gia trong nước giải khát, mứt, thạch, phomai,… Ngoài ra, nó còn có tác dụng tạo mùi thơm, tăng thêm độ ngọt, đậm đà cho thực phẩm. bằng cách kết hợp với Hfcs (xử lý bằng enzym).
-
Chất chống ăn mòn : Đây cũng là chất tẩm gỗ chống cháy và chất chống ăn mòn kim loại. Axit photphoric là nguyên liệu để sản xuất thủy tinh, gạch men, xử lý nước, công nghiệp xi mạ, sản xuất chất tẩy rửa, v.v.
-
Chất bảo quản : H3PO4 có khả năng làm chậm sự phát triển của vi khuẩn và nấm mốc trong công thức đường nên được sử dụng làm chất bảo quản.
-
Sản xuất các sản phẩm từ sữa : Axit photphoric cũng được sử dụng để sản xuất các sản phẩm từ sữa. Các muối của axit này có khả năng thay đổi độ đạm, độ pH để nâng cao chất lượng sản phẩm. Sữa, bơ và phô mai… là những ví dụ điển hình về các sản phẩm từ sữa có chứa axit photphoric.
-
Dược phẩm : Đồng thời, H3PO4 cũng được sử dụng trong dược phẩm.
Thận trọng khi sử dụng axit photphoric
Axit photphoric được sử dụng rộng rãi trong công nghiệp và nông nghiệp. Tuy nhiên, chúng ta cần khẳng định lại: Axit photphoric là một loại axit độc hại, gây ra nhiều hậu quả nguy hiểm cho sức khỏe nếu sử dụng không đúng cách.

-
Axit photphoric rất dễ bay hơi. Bỏng mắt, bỏng giác mạc, suy hô hấp, cháy nổ, kích ứng nguy hiểm… là những triệu chứng nguy hiểm khi chúng ta tiếp xúc trực tiếp với H3PO4 qua da. Vì vậy, trong quá trình sử dụng axit photphoric, bạn cần trang bị đầy đủ các thiết bị bảo hộ an toàn và kiến thức về cách sử dụng loại axit này.
-
H3PO4 là một chất có trong nước giải khát, nó cũng là một trong những nguy cơ gây loãng xương. Vì vậy, bạn nên hạn chế tối đa việc uống các loại nước ngọt đóng chai có chứa loại axit này.
-
H3PO4 có khả năng phản ứng ở nhiệt độ cao rất dễ cháy nổ. Vì vậy, khi sử dụng loại axit này, bạn cần đóng nắp chai cẩn thận và bảo quản nơi khô ráo , tránh ánh nắng mặt trời.
-
Bên cạnh đó, H3PO4 được sử dụng trong nhiều loại thực phẩm khác nhau, lượng phốt pho trong những thực phẩm này có thể làm tăng nguy cơ mắc bệnh sỏi thận, tiết niệu,… Vì vậy, hãy đọc kỹ thành phần. phần thức ăn nhanh và hạn chế sử dụng chúng . Đây là một trong những nguy cơ tiềm ẩn có thể gây hại cho sức khỏe của bạn.
Bài tập axit photphoric SGK Hóa học 11 có lời giải chi tiết
Để nắm chắc kiến thức về axit photphoric , cùng Manta.edu.vn vận dụng những lý thuyết đã học ở trên vào giải bài tập cơ bản về axit photphoric SGK Hóa học 11 sau đây.

Giải bài 1 trang 53 SGK Hóa học 11
Viết các phương trình hóa học dưới dạng phân tử và ion thu gọn cho phản ứng giữa axit photphoric với lượng dư:
một. Cặp ; b. Ca(OH)2 ; c. K2CO3
Câu trả lời:
Các chất lấy dư, muối thu được là muối trung hòa:
một. 2H3PO4 + 3BaO → Ba3(PO4)2 + 3H2O
Phương trình phân tử giống phương trình ion thu gọn
b. 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 6H2O
2H3PO4 + 3Ca2+ + 6OH- → Ca3(PO4)2 + 6H2O
c. 2H3PO4 + 3K2CO3 → 2K3PO4 + 3H2O + 3CO2↑
2H3PO4 + 3CO32- → 2PO43- + 3H2O + CO2↑
Giải bài 2 SGK Hóa 11 trang 53
Nêu những điểm giống nhau và khác nhau về tính chất hóa học giữa axit nitric và axit photphoric. Đưa ra các phản ứng hóa học để minh họa?
Câu trả lời:
Tính chất chung: Đều có tính axit
-
Đổi màu chất chỉ thị: Quỳ chuyển sang màu đỏ.
-
Phản ứng với bazơ, oxit bazơ không có tính khử (nguyên tố có số oxi hóa cao nhất):
3NaOH + H3PO4 → Na3PO4 + 3H2O
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
-
Phản ứng với một số muối của axit yếu, không có tính khử:
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2↑
2H3PO4 + 3Na2SO3 → 2Na3PO4 + 3H2O + 3SO2↑
khác nhau:
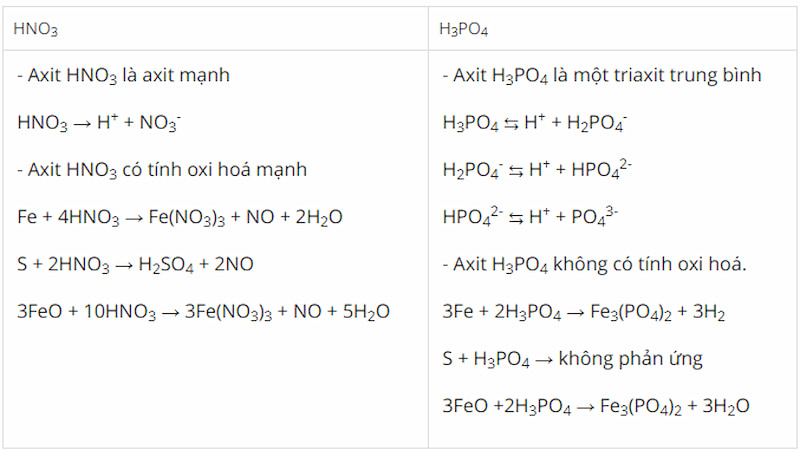
Giải bài 3 SGK trang 54 Hóa học 11
Phương trình điện ly tổng cộng của H3PO4 trong dung dịch là:
H3PO4 3H+ + PO43-
Khi cho HCl vào dung dịch:
A. Các cân bằng trên chuyển dịch theo chiều thuận.
B. Cân bằng trên chuyển dịch theo chiều nghịch.
C. Cân bằng trên không bị dịch chuyển.
D. nồng độ PO43- tăng.
Đáp án : Đáp án B.
Thêm HCl làm tăng nồng độ H+ trong dung dịch. Theo nguyên tắc chuyển dịch cân bằng thì cân bằng chuyển dịch theo chiều làm giảm nồng độ H+
⇒ cân bằng chuyển dịch theo chiều nghịch.
Giải bài 4 trang 54 SGK Hóa học 11
a) Lập các phương trình hóa học sau:
một. H3PO4 + K2HPO4 →
1 nốt ruồi 1mol
b. H3PO4 + NaOH →
1 nốt ruồi 1mol
c. H3PO4 + Ca(OH)2 →
2mol 1mol
d. H3PO4 + Ca(OH)2 →
2mol 3mol
Câu trả lời:
một. H3PO4 + K2HPO4 → 2KH2PO4
1 nốt ruồi 1mol
b. H3PO4 + Ca(OH)2 → CaHPO4 + 2H2O
1 nốt ruồi 1mol
c. 2H3PO4 + Ca(OH)2 → Ca(H2PO4)2 + 2H2O
2mol 1mol
d. 2H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 6H2O
2mol 3mol
Axit photphoric là một trong những bài học quan trọng trong chương trình Hóa học THPT. Hi vọng bài viết này sẽ giúp các bạn nắm vững những kiến thức cơ bản nhất về H3PO4. Các em đừng quên áp dụng vào giải bài tập thực hành Hóa học để thành thạo bài học này nhé. Manta.edu.vn chúc các bạn đạt kết quả cao trong học tập!



