Acetylen (công thức hóa học C2H2) là chất được sử dụng rộng rãi trong công nghiệp. Hãy cùng tìm hiểu khái niệm, tính chất và ứng dụng của chất quan trọng này trong bài viết dưới đây.
khái niệm axetilen
Acetylene (hay Acetylene), với tên hệ thống là Ethyne là một hydrocacbon và cũng là anken đơn giản nhất. Axetilen (C2H2) là chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước.
-
Công thức phân tử: C2H2
-
Khối lượng phân tử: 26
-
Cấu tạo phân tử: Axetilen có công thức cấu tạo: H – C ≡ C – H. Viết tắt là HC ≡ CH.
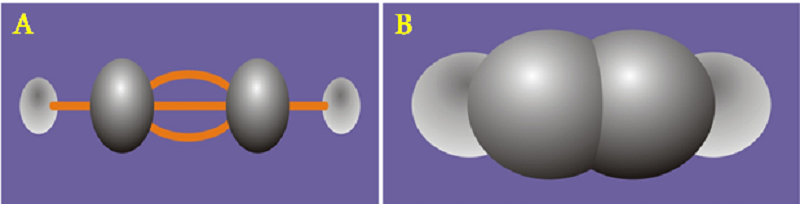
Đặc điểm cấu trúc:
-
Trong công thức cấu tạo của axetilen, giữa hai nguyên tử cacbon có ba liên kết, gọi là liên kết ba.
-
Trong liên kết ba này còn 2 liên kết kém bền hơn, dễ bị bẻ gãy lần lượt trong các phản ứng hóa học hữu cơ. Đây là yếu tố quyết định tính chất hóa học đặc trưng của axetylen.
Tính chất vật lý của axetilen
Acetylen (C2H2) được biết đến là một chất khí hoàn toàn không màu , không mùi , ít tan trong nước và nhẹ hơn không khí. Acetylene trong môi trường hiện nay sẽ có nhiều mùi khác nhau, mùi này do tạp chất gây ra.

Tính chất hóa học của axetilen
Với đặc điểm liên kết như trên, axetilen có những tính chất hóa học đặc trưng sau:
Cháy trong không khí (Tác dụng với oxi)
-
Tương tự như etilen và metan, khi đốt cháy hoàn toàn axetilen tạo ra khí cacbonic và hơi nước, phản ứng tỏa nhiệt.
-
Phương trình phản ứng:
2C2H2(k) + 5O2(k) —> 4CO2(k) + 2H2O(h) (điều kiện nhiệt độ)
Nhận xét: Khi đốt cháy axetilen thu được số mol CO2 lớn hơn số mol H2O.
Làm mất màu dung dịch brom
Trong liên kết ba của phân tử axetilen có hai liên kết kém bền hơn. Vì vậy, chúng tôi hy vọng axetylen sẽ làm mất màu dung dịch brom tương tự như etilen. Cùng làm thí nghiệm sau:
Cho axetilen đi qua dung dịch brom (Br2) ban đầu có màu da cam. Quan sát hiện tượng trên ta thấy nước brom mất màu . Từ thí nghiệm này có thể kết luận axetilen có phản ứng với dung dịch brom ban đầu.
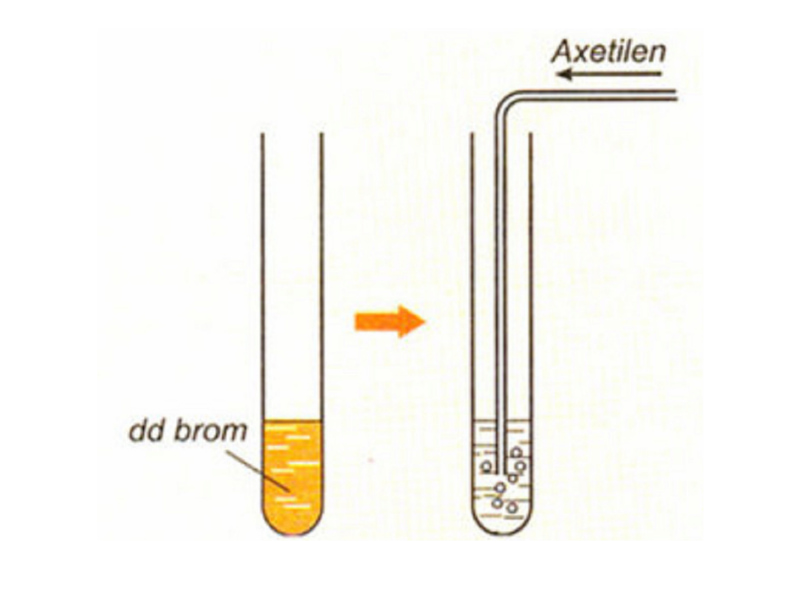
Phương trình hóa học:
HC ≡ CH + Br2 —> Br-CH=CH – Br (đibrometylen)
HC CH + 2Br2 —> Br2CH-CHBr2 (tetrabromethane)
Ở điều kiện thích hợp axetilen còn tham gia phản ứng cộng với nhiều chất khác như H2, Cl2…
HC≡CH + H2 → CH2=CH2
HC≡CH + 2H2 → CH3-CH3
Vì vậy, axetilen có đóng góp rất “tích cực” trong hóa học khi dùng để điều chế các hợp chất khác.
Cách điều chế axetilen?
Axetilen được điều chế như thế nào? Trong phòng thí nghiệm và trong công nghiệp người ta điều chế axetilen theo cách như nhau. Có 3 cách dưới đây.
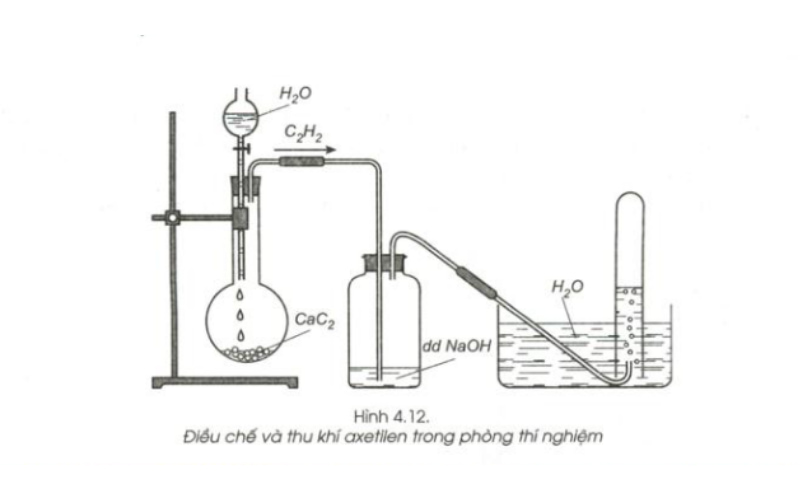
-
Dùng canxi cacbua (CaC2) tác dụng với nước theo phương trình phản ứng sau:
CaC2 + 2H2O → C2H2 + Ca(OH)2
-
Cho cacbon phản ứng với hiđro khi có hồ quang điện sẽ tạo ra C2H2 theo phương trình phản ứng:
2C + H2 → C2H2 (hồ quang điện)
-
Nhiệt phân metan (CH4): Ở nhiệt độ cao, sau đó làm lạnh nhanh
2CH4 → C2H2 + 3H2 (Điều kiện: 1500 °C)
ứng dụng axetylen
Acetylene có vô số ứng dụng thực tế. Nổi bật nhất, axetylen được sử dụng để sản xuất các hợp chất hóa học sau:

-
Ứng dụng trong hàn: Một trong những ứng dụng quan trọng nhất của axetylen là làm nhiên liệu trong đèn khò oxy-axetylen để hàn và cắt kim loại. Khi C2H2 cháy trong O2, nó tạo ra ngọn lửa có nhiệt độ lên tới 3000 °C. Chúng ta có thể quan sát hoạt động này thường xuyên nhưng không phải ai cũng biết trong đèn đỏ có chứa loại khí này. Hoạt động này sẽ giúp cho việc thi công, lắp ráp và cắt kim loại trở nên dễ dàng và nhanh chóng.
-
Nguyên liệu sản xuất hóa chất: Trong công nghiệp, axetilen là nguyên liệu để sản xuất nhiều loại hóa chất quan trọng như poly(vinyl clorua) – dùng để sản xuất nhựa PVC, cao su, axit axetic….
-
Acetylene được sử dụng làm nguyên liệu thô để sản xuất monome , và từ đó để tạo ra các polyme khác, sợi tổng hợp, cao su, muội than, v.v.
-
Axetylen được dùng để sản xuất axit axetic , rượu etylic, v.v.
-
Dùng làm nguyên liệu sản xuất hóa chất .
Phân biệt axetilen, metan, etilen
Để phân biệt axetilen, metan và etilen người ta dùng các cách nhận biết chung như sau:

Bước 1: Để phân biệt axetilen, metan và etilen trước hết ta cần biết tính chất riêng của từng chất cụ thể.
Bước 2: Chọn thuốc thử thích hợp.
Bước 3: Trình bày phương pháp nhận biết axetilen, metan và etilen theo thứ tự các bước:
-
Đánh số thứ tự các lọ đựng 3 hóa chất.
-
Tiến hành nhận biết bằng thuốc thử.
-
Ghi lại những gì đã xảy ra.
-
Hiện phương trình hóa học.
|
Chất nhận |
Loại thuốc thử |
hiện tượng |
phương trình hóa học |
|
Mêtan (CH4) |
khí clo |
Làm mất màu vàng lục của khí clo. |
CH4 + Cl2 → CH3Cl + HCl |
|
Etylen (C2H4) |
dung dịch brom |
Làm mất màu vàng nâu của dung dịch nước brom. |
C2H4 + Br2 → C2H4Br2 |
|
Axêtylen (C2H2) |
– Dung dịch brom – AgNO3/NH3 |
– Làm mất màu vàng nâu của dung dịch nước brom. – Có kết tủa màu vàng |
– C2H2 + Br2 → C2H2Br4 – C2H2 + 2AgNO3 + 2NH3 → 2NH4NO3 + C2Ag2 |
Bài tập SGK axetilen có đáp án gợi ý
Từ những kiến thức về axetilen ở trên các em sẽ vận dụng những kiến thức đó để giải một số bài tập cơ bản trong sgk hóa học 9 sau đây.

Bài 1 trang 122 SGK Hóa học 9
Hãy cho biết trong các chất sau:
CH3–CH3 ; CHỈ CH; CH2=CH2; CH4; CHỈ CÓ C–CH3.
a) Chất nào có liên kết ba trong phân tử?
b) Chất nào làm mất màu dung dịch brom?
Câu trả lời gợi ý:
a) Có hai chất: CHỈ CH và CHỈ C–CH3 có một liên kết ba.
b) Trong số các chất đã cho, có 3 chất có khả năng làm mất màu dung dịch brom gồm:…. CHỈ CÓ HÓA CHẤT; CH2=CH2 và CHỈ CÓ C–CH3.
Bài 3 SGK Hóa học 9 trang 122
Biết 0,1 lit khí etilen (dktc) làm mất màu vừa đủ 50ml dung dịch brom. Nếu dùng 0,1 lít khí axetilen đktc thì làm mất màu tối đa bao nhiêu ml dung dịch brom trên?
Câu trả lời gợi ý:
Phương trình phản ứng:
C2H4 + Br2 → C2H4Br2 (1)
C2H2 + 2Br2 → C2H2Br4 (2)
Từ phương trình (1) và (2), ta thấy:
Tỉ lệ nC2H4 : nBr2 = 1:1
nC2H2 : nBr2 = 1:2
⇒ Số mol brom tối đa phản ứng với C2H2 gấp đôi C2H4 nên thể tích dung dịch brom cần để phản ứng với C2H2 cũng gấp đôi khi phản ứng với C2H4.
Thể tích Br2 cần để phản ứng hết với 0,1l axetilen là: 50ml × 2 = 100ml.
Bài 4 trang 122 SGK Hóa học 9
Đốt cháy 28ml hỗn hợp khí metan và axetilen cần dùng 67,2ml khí oxi.
a) Tính phần trăm thể tích của mỗi khí trong hỗn hợp.
b) Tính thể tích khí CO2 sinh ra.
(Các thể tích khí đo ở cùng nhiệt độ và áp suất)
Câu trả lời gợi ý:
Vì các thể tích khí được đo trong cùng điều kiện nhiệt độ và áp suất nên tỉ lệ về thể tích cũng chính là tỉ lệ về số mol.
Gọi thể tích khí metan (CH4) là x (ml); thể tích axetilen (C2H2) là y (ml)
Theo bài: Vhh khí = 28 (ml)
→ x + y = 28 (1)
Phương trình phản ứng:
CH4 + 2O2 → CO2 + 2H2O (nhiệt độ)
x → 2x —> x (ml)
2C2H2 + 5O2 → 4CO2 + 2H2O
y —> 2,5y → 2y (ml)
Theo đề bài, thể tích khí oxi là 67,2 ml.
→ 2x + 2,5y = 67,2ml (2)
Từ (1) và (2) giải hệ phương trình: x = 5,6 (ml) và y = 22,4 (ml).
a) Phần trăm thể tích của mỗi khí là:
%V(CH4) = (5,6/28) x 100 = 20%
%V(C2H2) = 100 – 20 = 80%
b/ Theo phương trình phản ứng trên có:
Thể tích CO2 = x + 2y = 5,6 + 2,22,4 = 50,4 (ml)
Bài viết trên đã cung cấp đầy đủ thông tin về khái niệm, tính chất và những ứng dụng quan trọng nhất của axetilen. Hi vọng những thông tin này sẽ giúp các bạn có thêm những kiến thức bổ ích và áp dụng chúng trong học tập cũng như trong thực tế.



