điện li là gì? điện li là gì? Làm thế nào để phân biệt chất điện li mạnh và chất điện li yếu? Cùng manta.edu.vn học chi tiết lý thuyết và thực hành một số bài tập điện li nhé.
Điện li là gì? Chất điện li là gì?
điện li (ion hóa) là quá trình phân ly các chất trong nước để tạo thành ion âm (anion) và ion dương (cation). Đây là nguyên nhân khiến axit, bazơ hoặc dung dịch muối dẫn điện.
Cụ thể hơn, đây là quá trình mà một nguyên tử hoặc phân tử thu được điện tích âm hoặc dương bằng cách nhận hoặc mất electron để tạo thành ion. Quá trình này thường đi kèm với nhiều biến đổi hóa học khác.
-
Ion dương được tạo thành khi chúng hấp thụ đủ năng lượng (lớn hơn hoặc bằng thế năng tương tác của các electron trong nguyên tử) để giải phóng các electron (còn gọi là electron tự do). Năng lượng ion hóa là năng lượng cần thiết để quá trình này diễn ra.
-
Ion âm được hình thành khi một electron tự do đập vào một nguyên tử tích điện trung tính, nguyên tử này ngay lập tức bị giữ lại và thiết lập một hàng rào thế năng với nguyên tử. Lý do là vì nó không còn đủ năng lượng để thoát ra khỏi nguyên tử này nữa, từ đó tạo thành ion âm.
Trường hợp của điện li chỉ đơn giản là một chất có liên kết ion hoặc liên kết cộng hóa trị có cực phân tách thành các ion riêng biệt trong môi trường nước, điển hình là NaCl.
Chất điện li (chất điện li, chất điện li): Là những chất khi tan trong nước (hoặc nóng chảy) phân li thành ion. Chúng bao gồm: axit, bazơ và muối.
điện li được biểu diễn bằng phương trình điện li.
Ví dụ:
NaCl → Na+ + Cl-
NaOH → Na+ + OH-
HCl → H+ + Cl-
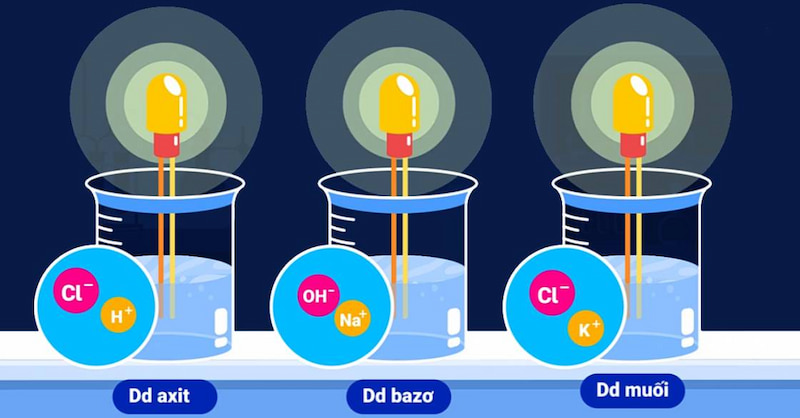
Nguyên nhân dẫn điện của dung dịch axit, bazơ, muối
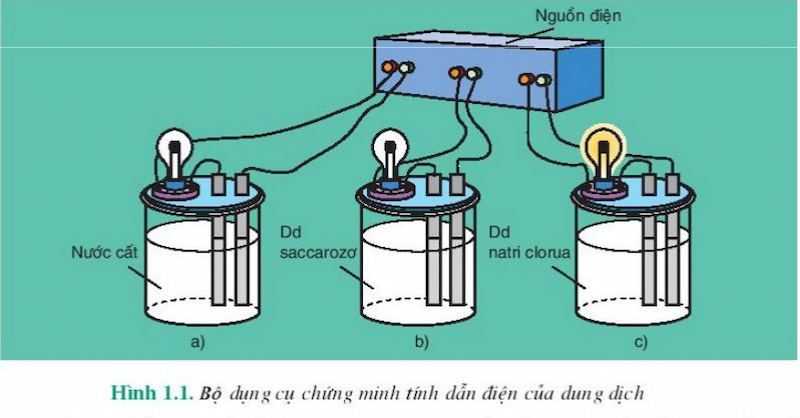
Qua thí nghiệm năm 1887, Arenius đã kết luận rằng: Dung dịch axit, bazơ và muối có khả năng dẫn điện vì dung dịch của chúng chứa các hạt mang điện chuyển động tự do, gọi là ion (gồm anion và cation).
Cụ thể, phân tử nước được phân cực thành cực dương và cực âm vì nguyên tử oxy có độ âm điện lớn hơn nguyên tử hydro. Do đó, cặp electron dùng chung bị lệch về phía oxy. Do đó, khi một chất có liên kết ion hoặc liên kết cộng hóa trị có cực khi tan trong nước, phân tử của nó sẽ bị bao quanh và tương tác với phân tử nước, phân tách các chất này thành ion, ion dương. (-) được phân tách bởi một nguyên tử oxy (tích điện âm) và ion âm (-) được phân tách bởi một nguyên tử hydro (tích điện dương). Liên kết giữa các nguyên tử bị phá vỡ nên quá trình này giải phóng năng lượng.
Trong khi đó, các dung dịch như glixerol, sacarozơ, ancol etylic không dẫn điện được vì trong dung dịch chúng không phân li thành ion âm và dương. Nguyên nhân là do phân tử có liên kết phân cực nhưng rất yếu.
Phân loại chất điện li
Để phân loại các chất điện li, người ta làm thí nghiệm sau. Chuẩn bị 2 cốc: HCl 0,10M và CH3COOH 0,10M, lắp vào thiết bị như hình vẽ. Khi cho cùng một nguồn vào đầu ống dây dẫn thì bóng đèn bên dung dịch HCl sáng hơn bóng đèn bên dung dịch CH3COOH. Như vậy ta có thể kết luận: Nồng độ các ion trong HCl lớn hơn trong CH3COOH, tức là số phân tử từ HCl phân li thành ion nhiều hơn.
Dựa vào thí nghiệm này, người ta chia điện li thành 2 loại: điện li mạnh và điện li yếu .

điện li mạnh
Định nghĩa: điện li mạnh là chất khi tan trong nước thì phân li ra ion .
Ví dụ về điện lis mạnh:
-
Axit HCl, HNO3, H2SO4,…
-
Bazơ mạnh như NaOH, KOH, Ba(OH)2 Ca(OH)2,…
-
Hầu hết các muối của axit mạnh và bazơ mạnh như: NaCl, KNO3, KCI, K2SO4,…
Trong phương trình điện li cho điện li mạnh, mũi tên 1 chiều được sử dụng để chỉ hướng của quá trình điện li.
Ví dụ về phương trình điện li:
-
NaCl là một điện li mạnh, nếu trong dung dịch chứa 100 phân tử NaCl hòa tan thì cả 100 phân tử này sẽ phân ly thành ion. NaCl → Na+ + Cl-
-
Trong dung dịch Na2SO4 0,1M, do điện li hết Na2SO4 nên tính được nồng độ các ion do Na2SO4 phân ly lần lượt là 0,2M và SO2. Phương trình phân ly: Na2SO4 → 2Na+ +S04(2-)
điện li yếu
Định nghĩa: Chất yếu là chất khi tan trong nước chỉ một phần phân tử chất tan phân li thành ion , phần còn lại tồn tại dưới dạng phân tử trong dung dịch.
Ví dụ về các chất điện li yếu:
-
Axit yếu như axit hữu cơ CH3COOH, axit HClO, H2S, HE, HCN H2SO3,…
-
Bazơ yếu như Bi(OH)3, Mg(OH)2,…
Trong phương trình điện li của chất điện li yếu người ta dùng mũi tên hai chiều.
Ví dụ về phương trình điện li:
CH3COOH CH3COO- + H+
Mg(OH)2 Mg2+ + 2OH-
điện li của điện li yếu là một quá trình thuận nghịch. Cân bằng điện li được thiết lập khi tốc độ phân ly của các ion bằng tốc độ kết hợp của các ion vào phân tử. Đây là những điểm cân bằng động với hằng số cân bằng K và giống như mọi điểm cân bằng khác, chúng tuân theo nguyên lý dịch chuyển cân bằng LG Satellie.
Pha loãng có ảnh hưởng gì đến điện li? Khi pha loãng dung dịch, các ion (+) và (-) của điện li dịch chuyển ra xa nhau, ít có khả năng va chạm để tái tạo phân tử nên điện li tăng lên.
Bài tập điện li SGK Hóa học lớp 11 có lời giải chi tiết
Để giúp bạn đọc nắm chắc kiến thức về điện li, dưới đây là một số bài tập cơ bản SGK Hóa học 11 có lời giải chi tiết.

Giải bài 1 trang 7 SGK Hóa học 11
Dung dịch axit như HCl, bazơ như NaOH và muối như NaCl dẫn điện, nhưng dung dịch như rượu etylic, sucrose và glixerol không dẫn điện vì điều gì?
Câu trả lời:
Trong dung dịch: Axit, bazơ, muối phân li thành ion dương và ion âm chuyển động tự do nên dung dịch có khả năng dẫn điện.
Ví dụ :
HCl → H+ + Cl-
NaOH → Na+ + OH-
NaCl → Na+ + Cl-
Còn các dung dịch như rượu etylic, saccarozơ, glixerol không dẫn điện vì trong dung dịch chúng không phân li thành ion dương và ion âm.
Giải bài 2 SGK Hóa 11 trang 7
điện li, chất điện li là gì? điện li gồm những loại chất nào? điện li mạnh và điện li yếu là gì? Cho ví dụ và viết phương trình điện li của chúng?
Câu trả lời:
điện li là độ phân ly thành cation (ion dương) và anion (ion âm) của phân tử điện li khi hòa tan trong nước.
-
điện li là những chất tan trong nước tạo thành dung dịch dẫn điện.
-
Các chất là chất điện li như axit, bazơ, muối đều tan trong nước.
-
điện li mạnh là những chất khi tan trong nước thì phân li ra ion.
Ví dụ:
H2SO4 → 2H+ + SO4(2-)
KOH → K+ + OH-
Na2SO4 → 2Na+ + SO42-
Chất điện li yếu là những chất khi tan trong nước chỉ một phần phân tử bị phân li thành ion, phần còn lại tồn tại dưới dạng phân tử trong dung dịch.
Ví dụ: H2S H+ + HS-
Giải bài 3 SGK trang 7 Hóa học 11
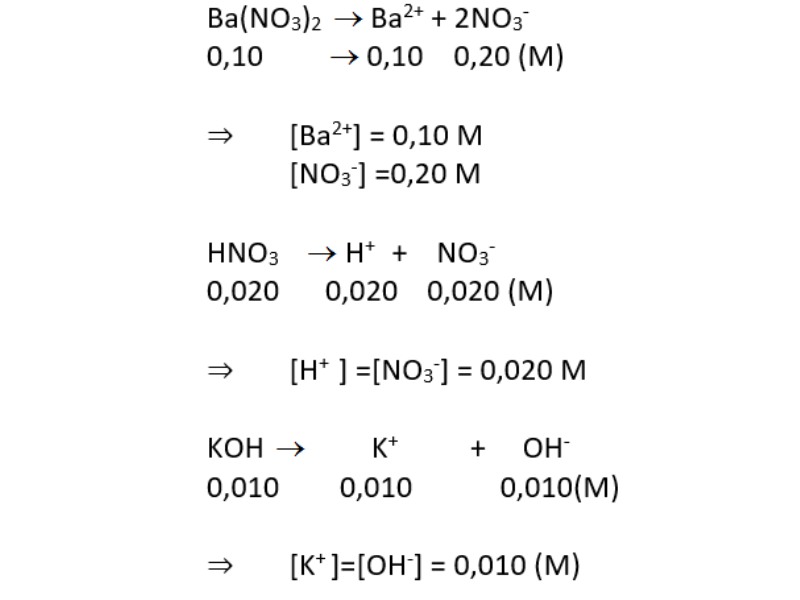
Viết phương trình điện li của các chất sau:
một. điện li mạnh: Ba(NO3)2 0,10 M; HNO3 0,020 M; KOH 0,010 M. Tính nồng độ mol của mỗi ion trong dung dịch.
b. Chất điện li yếu HClO; HNO2.
Câu trả lời:
một. điện li mạnh:
b. điện li yếu: HClO, HNO2
HClO ⇌ H+ + ClO-
HNO2 H+ + NO2-
Giải bài 4 trang 7 SGK Hóa 11
Chọn câu trả lời đúng trong các câu sau:
Dung dịch điện li dẫn điện vì:
A. Độ chuyển dời của êlectron.
B. Chuyển vị của các cation.
C. Chuyển vị của các phân tử chất hòa tan.
D. Chuyển vị của cả cation và anion.
Trả lời : Đáp án D.
Vì khi hòa tan (trong nước) các phân tử điện li phân ly thành cation và anion.
Giải bài 5 SGK Hóa 11 trang 7
Chất nào sau đây không dẫn điện được?
A. KCl rắn, khan.
B. CaCl2 nóng chảy.
C. NaOH nóng chảy.
D. HBr tan được trong nước.
Đáp án : Đáp án A.
Vì KCl là chất rắn nên khan tồn tại dưới dạng mạng ion rất ổn định. Do đó, chúng không thể phân ly các ion dương và âm (chuyển động tự do) nên không có khả năng dẫn điện.
Như vậy, bài viết này đã giúp bạn đọc giải đáp những thắc mắc xung quanh điện li , bao gồm: điện li là gì, điện li là gì, cách phân biệt chất điện li mạnh và chất điện li yếu cùng một số bài thực hành về chủ đề này. manta.edu.vn hy vọng những thông tin này sẽ hữu ích với bạn.



