Liên kết cộng hóa trị là một liên kết hóa học cơ bản phổ biến. Đây là một trong những kiến thức quan trọng trong chương trình Hóa học THPT. Vậy liên kết này là gì? Bài viết dưới đây của Manta.edu.vn sẽ giúp các bạn có thêm thông tin chi tiết về khái niệm, phân loại tính chất và một số bài tập vận dụng trong SGK Hóa học 10.
Lịch sử nghiên cứu Liên kết cộng hóa trị
Trước khi tìm hiểu chi tiết Liên kết cộng hóa trị là gì, hãy cùng tìm hiểu lịch sử nghiên cứu, các mốc thời gian quan trọng về liên kết này nhé!
-
1919 : Irving Langmuir đề cập đến liên kết này vào năm 1919 với mục đích mô tả các cặp electron được chia sẻ bởi các nguyên tử lân cận. Mặc dù vậy, ý tưởng về Liên kết cộng hóa trị có thể đã được tìm ra trước đó.
-
1916 : Gilbert N. Lewis mô tả sự chia sẻ các cặp electron giữa các nguyên tử. Ông đề xuất rằng: Một nguyên tử tạo ra đủ Liên kết cộng hóa trị để lấp đầy lớp vỏ ngoài cùng. Ông đã giới thiệu ký hiệu Lewis, chấm electron và cấu trúc chấm Lewis, trong đó các electron hóa trị được biểu diễn dưới dạng các chấm xung quanh các ký hiệu nguyên tử. Các cặp electron nằm giữa các nguyên tử biểu thị Liên kết cộng hóa trịs, nhiều cặp electron biểu thị nhiều liên kết. Ngoài ra còn có cách biểu diễn liên kết đôi, ba dưới dạng đường thẳng.
-
1927 : Walter Heitler và Fritz London được ghi nhận là những người đầu tiên giải thích thành công một liên kết hóa học (cụ thể là một phân tử hydro) bằng cơ học lượng tử.
-
1939 : Lần đầu tiên thuật ngữ “Liên kết cộng hóa trị” được sử dụng.
Liên kết cộng hóa trị là gì?
Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron dùng chung. (Viết tắt: LKCHT)
Nói cách khác, liên kết này được hiểu là liên kết giữa hai nguyên tử hoặc ion mà trong đó các cặp electron sẽ dùng chung.
Mỗi cặp electron dùng chung giữa hai nguyên tử được gọi là cặp liên kết, ngược lại nếu không dùng chung thì gọi là cặp đơn độc. Với nhiều phân tử, việc chia sẻ các electron làm cho mỗi nguyên tử đạt được cấu hình electron ổn định.
Liên kết cộng hóa trị hình thành giữa các nguyên tử giống hệt nhau – Sự hình thành các đơn nguyên
Trong phần này, chúng ta khám phá các liên kết cộng hóa trị hình thành giữa các nguyên tử giống nhau thông qua sự hình thành Hydro (H2) và Nitrogen (N2).
Sự hình thành phân tử Hydro (H2)
Nguyên tử H (Z = 1) có cấu hình electron ls1. Trong đó, 2 nguyên tử H liên kết với nhau bằng cách mỗi nguyên tử H góp 1 electron tạo thành cặp electron chung. Như vậy, trong phân tử H2, mỗi nguyên tử H có 2 electron giống cấu hình electron bền của khí hiếm heli là:
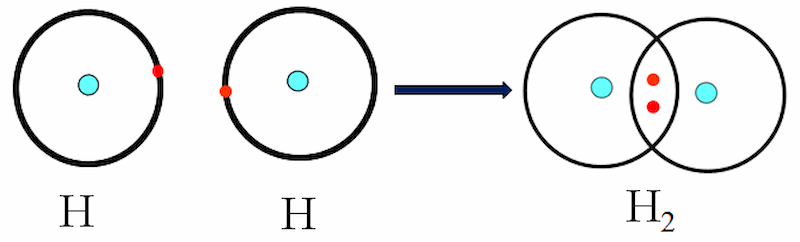
Mỗi dấu chấm bên cạnh ký hiệu nguyên tố đại diện cho một e ngoài cùng.
-
Công thức electron : H: H
-
Công thức cấu tạo : HH. Giữa 2 nguyên tử H có cặp electron liên kết biểu diễn bằng dấu gạch ngang (-).
-
Đây là một liên kết duy nhất .
Sự hình thành phân tử Nitơ (N2)
Nguyên tử N (Z = 7) có cấu hình electron là: 1s22s22p với 5 electron ở lớp vỏ ngoài cùng.
Trong phân tử nitơ N, mỗi nguyên tử phải dùng chung 3 electron để đạt cấu hình electron của nguyên tử khí hiếm gần nhất là Ne.
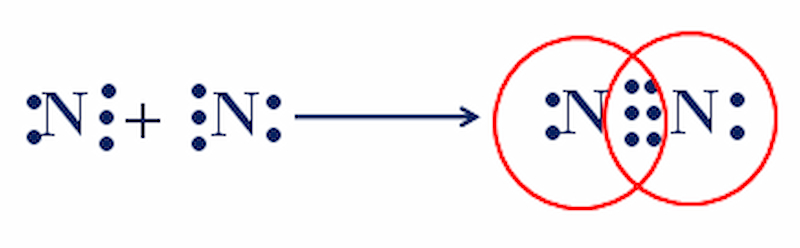
Hai nguyên tử N liên kết với nhau bằng 3 cặp electron. Liên kết được thể hiện bằng ba dấu gạch ngang (=), đây là liên kết ba.
-
Công thức electron : : N (6 chấm) N :
-
Công thức cấu tạo : N (3 viên gạch) N
Liên kết này mạnh đến mức khí nitơ không hoạt động về mặt hóa học ở nhiệt độ phòng.
Phần kết luận:
Từ sự hình thành phân tử Nitơ và Hiđro ở trên, ta có kết luận về Liên kết cộng hóa trị như sau:
-
Liên kết hình thành trong phân tử Hiđro và Nitơ là liên kết cộng hóa trị.
-
Liên kết cộng hóa trị là liên kết được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
-
Mỗi cặp electron dùng chung tạo thành một liên kết cộng hóa trị.
-
Phân tử H2 và N được tạo bởi hai nguyên tử của cùng một nguyên tố, có độ âm điện bằng nhau nên các cặp electron dùng chung không bị hút về phía nguyên tử nào. Do đó, đây là liên kết cộng hóa trị không cực.
Liên kết giữa các nguyên tử khác nhau – Sự hình thành hợp chất
Hãy cùng tìm hiểu về sự hình thành hợp chất – liên kết giữa các nguyên tử khác nhau thông qua sự hình thành Hydrogen chloride (HCl) và carbon dioxide (CO2).
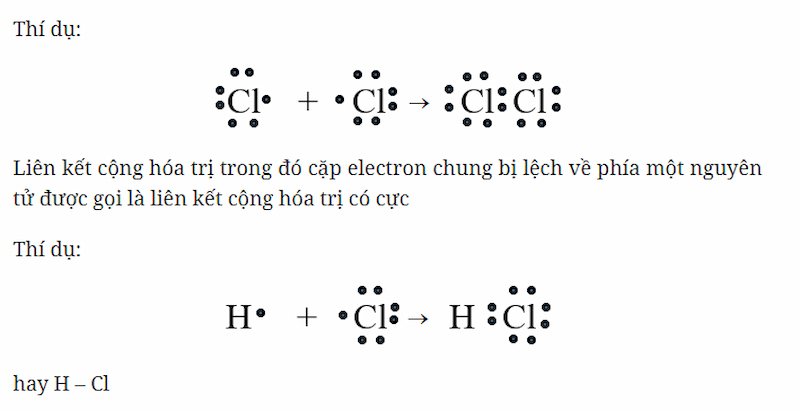
Sự hình thành phân tử hydro clorua (HCl)
Trong phân tử hiđro clorua, mỗi nguyên tử H và C góp 1 electron tạo thành cặp electron dùng chung.
Độ âm điện của clo là 3,16 lớn hơn độ âm điện của hiđro là 2,20 => Cặp electron liên kết lệch về phía clo, đây là liên kết cộng hóa trị có cực.
Kết luận :
-
Liên kết cộng hóa trị có cực: Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía nguyên tử.
-
Trong công thức electron của phân tử có cực, cặp electron dùng chung bị dịch chuyển về phía kí hiệu của nguyên tử có độ âm điện lớn hơn. Ví dụ: H :CI
Sự hình thành phân tử khí cacbonic (CO2) (có cấu tạo mạch thẳng):
Cấu hình electron của C (Z = 6) là 1s22s22p2 với 4 electron ở lớp vỏ ngoài cùng.
Cấu hình electron của O(Z=8) là 1s22s22p4 với 6 electron ở lớp vỏ ngoài cùng.
Trong phân tử CO2, nguyên tử C nằm chính giữa hai nguyên tử O. Nguyên tử C dùng chung với mỗi nguyên tử O 2 e, mỗi nguyên tử O dùng chung với nguyên tử C 2 e tạo 2 liên kết đôi.
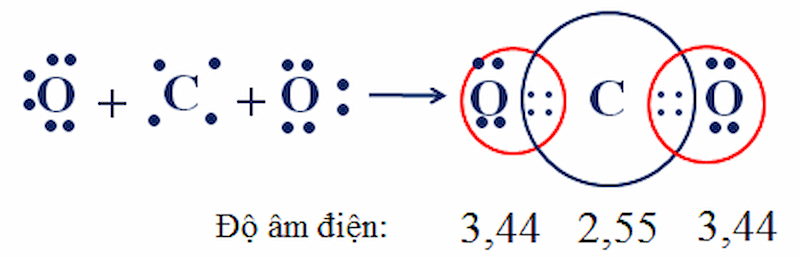
Từ sự tạo thành CO2, ta có nhận xét sau:
-
Theo công thức electron, mỗi nguyên tử C hoặc O có 8 electron ở lớp vỏ ngoài cùng, đạt cấu hình khí hiếm bền.
-
Độ âm điện của oxi là 3,44 lớn hơn độ âm điện của C là 2,55 => Cặp electron dùng chung bị lệch về phía oxi.
-
Liên kết giữa oxi và cacbon là có cực nhưng CO2 có cấu tạo mạch thẳng nên 2 liên kết đôi có cực (C=0) triệt tiêu lẫn nhau. Kết quả: CO2 là phân tử không phân cực.
Liên kết cộng hóa trị có bao nhiêu loại?
Như chúng ta đã biết, Liên kết cộng hóa trị là liên kết hóa học được hình thành bằng cách dùng chung một hoặc nhiều cặp electron giữa các nguyên tử. Vậy có bao nhiêu loại Liên kết cộng hóa trị? Hãy cùng Manta.edu.vn tìm hiểu cách phân loại Liên kết cộng hóa trị trong phần này nhé.
Liên kết cộng hóa trị có cực
cực Liên kết cộng hóa trị được hình thành khi các electron dùng chung giữa các nguyên tử không được chia đều.
-
Điều kiện xảy ra : Một bên của nguyên tử có độ âm điện lớn hơn bên kia (sẽ có lực hút mạnh hơn). Do đó, việc chia sẻ các điện tử là không đồng đều.
-
Đặc điểm : Phân tử nghiêng về phía chứa nguyên tử có độ âm điện nhỏ hơn, còn phía hơi âm chứa nguyên tử có độ âm điện lớn hơn.
-
Kết quả : Hợp chất cộng hóa trị được tạo thành sẽ có thế năng tĩnh điện.
Liên kết cộng hóa trị không cực
Liên kết cộng hóa trị không phân cực được tạo ra khi các nguyên tử chia sẻ các electron bằng nhau.
Điều kiện xảy ra : Cả hai nguyên tử đều có lực điện từ giống nhau hoặc giống nhau. Đặc biệt, các giá trị lực điện tử của chúng càng gần nhau thì lực hút càng mạnh. Điều tương tự cũng xảy ra trong các phân tử khí (diatomic).
Liên kết đơn phân tử
Liên kết đơn phân tử xảy ra khi cả hai phân tử đều có chung một cặp electron. So với liên kết đôi và ba, liên kết đơn yếu hơn và kém đậm đặc hơn, nhưng chúng là liên kết ổn định nhất. Điều này là do khả năng phản ứng của liên kết thấp, có nghĩa là sự mất e sẽ ít bị ảnh hưởng hơn.
Liên kết đôi phân tử
Liên kết đôi trong phân tử là tên gọi của hiện tượng: Hai nguyên tử dùng chung hai cặp electron với nhau. Liên kết này được thể hiện bằng hai dấu gạch ngang giữa hai nguyên tử trong cùng một phân tử. Liên kết này mạnh hơn liên kết đơn nhưng kém ổn định hơn.
Liên kết ba
Liên kết ba kém bền nhất trong số Liên kết cộng hóa trịs. Liên kết này xảy ra khi ba cặp electron được chia sẻ giữa hai nguyên tử trong cùng một phân tử.
Tính chất của chất có Liên kết cộng hóa trị
Các chất có Liên kết cộng hóa trị có các tính chất nổi bật sau:
-
Dạng tồn tại : Các chất chỉ có phân tử Liên kết cộng hóa trị có thể ở thể rắn (đường, sắt, lưu huỳnh,…), lỏng (rượu, nước,…) hoặc khí (clo, cacbonic, hiđro,…). Các chất này thường có điểm nóng chảy và sôi tương đối thấp, đồng thời có entanpy hóa hơi và nhiệt hạch thấp hơn.
-
Trong các chất phân cực : Ví dụ: đường, rượu etylic… sẽ tan nhiều trong dung môi phân cực như nước.
-
Ở các chất không phân cực : Ví dụ: ion, lưu huỳnh… tan trong các dung môi không phân cực như cacbon tetraclorua, benzen,… Các chất chỉ có Liên kết cộng hóa trị không phân cực không có khả năng dẫn điện ở mọi trạng thái.
Mối liên hệ giữa Liên kết cộng hóa trị không cực, Liên kết cộng hóa trị có cực và liên kết ion
Vậy mối quan hệ giữa Liên kết cộng hóa trị có cực, Liên kết cộng hóa trị không cực và liên kết ion là gì?
-
Trong phân tử, nếu hai nguyên tử dùng chung một cặp electron thì sẽ tồn tại liên kết cộng hóa trị không phân cực.
-
Trong phân tử, nếu cặp electron dùng chung bị lệch về một phía của nguyên tử có độ âm điện lớn hơn thì đó là liên kết cộng hóa trị có cực.
-
Trong phân tử, nếu cặp electron dùng chung lệch hẳn về một nguyên tử thì ta sẽ có liên kết ion.
Như vậy, liên kết ion được coi là trường hợp đặc biệt của Liên kết cộng hóa trị.
Hiệu độ âm điện và liên kết hóa học
Hiệu độ âm điện được dùng để đánh giá các loại liên kết trong phân tử hợp chất. Cụ thể, sự phân loại tương đối liên kết hóa học theo thang độ âm điện của Pau – Linh như sau:
| Liên kết | Hiệu độ âm điện |
| Từ 0 đến <0,4 | Liên kết cộng hóa trị không cực |
| Từ 0,4 đến <1,7 | Liên kết cộng hóa trị có cực |
| >= 1,7 | Liên kết ion |
Trên thực tế, sự khác biệt về độ âm điện chỉ đưa ra dự đoán lý thuyết về loại liên kết trong phân tử. Ta có một ví dụ về chênh lệch độ âm điện và liên kết hóa học như sau:
-
Phân tử NaCl có hiệu độ âm điện = 3,16 – 0,93 = 2,23 > 1,7 => Vậy liên kết giữa Na và C là liên kết ion.
-
Phân tử HCL có hiệu độ âm điện = 3,16 – 2,2 = 0,96 => Như vậy liên kết giữa H và C là liên kết cộng hóa trị có cực.
-
Phân tử H2 có hiệu độ âm điện = 220 – 2,20 = 0,0 => Vậy đây là liên kết cộng hóa trị không phân cực.
Bài tập Liên kết cộng hóa trị SGK Hóa học lớp 10 có lời giải
Hãy vận dụng kiến thức đã học ở trên vào thực hành giải một số bài tập Hóa học 10 về Liên kết cộng hóa trị sau đây.

Bài 1 (trang 64 SGK Hóa học 10):
Liên kết cộng hóa trị là liên kết
A. Giữa các phi kim.
B. Trong đó cặp electron dùng chung bị lệch về một nguyên tử.
C. Được hình thành do dùng chung electron của hai nguyên tử khác nhau.
D. Được tạo thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung.
Giải: D là đáp án đúng.
Bài 2 (trang 64 SGK Hóa học 10):
Chọn câu đúng trong các câu sau:
A. Trong Liên kết cộng hóa trị cặp electron bị lệch về phía nguyên tử có độ âm điện nhỏ hơn.
B. Liên kết cộng hóa trị mà cực của chúng được hình thành giữa hai nguyên tử có hiệu độ âm điện từ 0,4 đến nhỏ hơn 1,7.
C. Liên kết cộng hóa trị không phân cực được tạo nên từ những nguyên tử có tính chất hóa học khác nhau.
D. Nếu hiệu độ âm điện giữa hai nguyên tử lớn thì phân tử đó phân cực yếu.
Giải: B là đáp án đúng.
Bài 3 (trang 64 SGK Hóa học 10):
Độ âm điện của nguyên tử đặc trưng cho
A. Khả năng hút electron của nguyên tử khi hình thành liên kết hóa học.
B. Khả năng nhường electron của nguyên tử cho nguyên tử khác.
C. Khả năng tham gia phản ứng mạnh hay yếu của nguyên tử.
D. Khả năng nhường một proton cho nguyên tử khác của một nguyên tử.
Chọn câu trả lời đúng.
Giải pháp: A là câu trả lời đúng.
Bài 4 (trang 64 SGK Hóa học 10)
Thế nào là liên kết ion, Liên kết cộng hóa trị không cực, Liên kết cộng hóa trị có cực, Liên kết cộng hóa trị có cực. Cho ví dụ minh họa.
Câu trả lời:
Liên kết ion là liên kết được hình thành do lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Ví dụ: K+ + Cl- → KCl.
Liên kết cộng hóa trị không phân cực là liên kết được tạo ra giữa hai nguyên tử bằng các cặp electron dùng chung.
Như vậy, qua bài viết này chúng ta đã hiểu rõ Liên kết cộng hóa trị là gì, bên cạnh phân loại, tính chất và thực hành một số bài tập cơ bản trong SGK Hóa học 10. Hy vọng thông tin này sẽ giúp bạn biết. thêm nhiều kiến thức bổ ích và giải bài tập Liên kết cộng hóa trị thành thạo hơn. Truy cập website Manta.edu.vn để cập nhật thêm nhiều thông tin thú vị về Hóa học nhé!



