Nitơ là một nguyên tố hóa học chiếm khoảng 78% bầu khí quyển của Trái đất và là một thành phần không thể thiếu của tất cả các sinh vật sống. Toàn bộ lý thuyết cơ bản về khí nitơ như: Khái niệm, tính chất, ứng dụng, điều chế sẽ được giải đáp chi tiết nhất trong bài viết dưới đây.
Khí nitơ là gì?
Khái niệm : Nitơ (tên tiếng Anh là nitrogen) là nguyên tố hóa học ở vị trí số 7, chu kì 2, thuộc nhóm VA trong bảng tuần hoàn.

Ký hiệu : N2 và thường tồn tại dưới dạng khí có liên kết thứ 3.
Cấu hình electron nguyên tử : 1s2 2s2 2p3. Như vậy cấu tạo electron của N2 gồm 2 lớp, lớp ngoài cùng có 5 electron hoạt động. Do đó, khí này được coi là một phi kim hoạt động cao.
Công thức cấu tạo : N ≡ N
Trạng thái tự nhiên của nitơ
Sau khi biết khí nitơ là gì, chúng ta hãy tìm hiểu sự tồn tại của nó xung quanh chúng ta. Trong tự nhiên, nitơ tồn tại ở dạng tự do và ở dạng hợp chất .
-
Nitơ thiên nhiên chiếm 78,16% thể tích không khí, là hỗn hợp của 2 đồng vị: 14/7N (99,63%) và 15/7N (0,37%).
-
Nitơ ở dạng hợp chất có nhiều trong natri nitrat NaNO3 với tên gọi natri saltpeter.
-
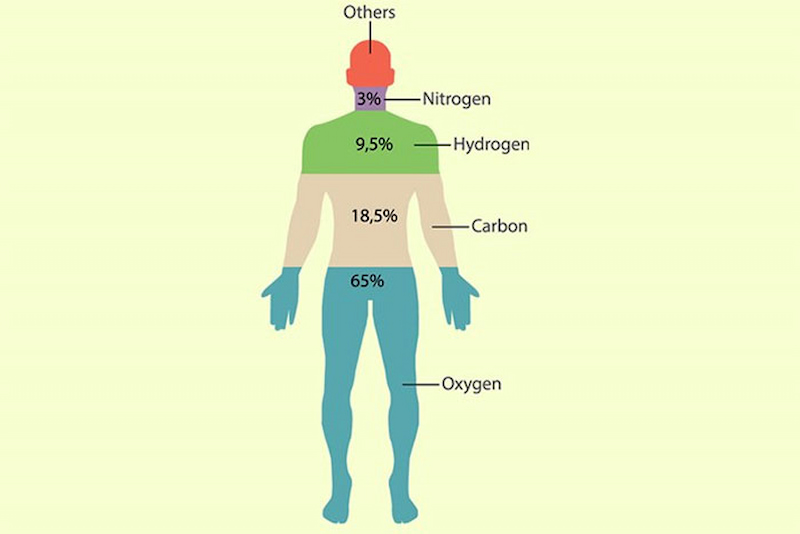
Nitơ có mặt trong tất cả các sinh vật sống, chủ yếu ở dạng axit amin (protein) và cả trong axit nucleic (RNA và DNA) . Theo nghiên cứu, cơ thể con người chứa khoảng 3% nitơ tính theo trọng lượng. Nó là nguyên tố phổ biến thứ tư trong cơ thể sau oxy, carbon và hydro.
Tính chất vật lý của khí nitơ
Sau đây là những tính chất vật lý cơ bản của nitơ mà bạn cần nhớ:

-
Nitơ là chất khí không màu, không mùi, không vị, có khối lượng nhẹ hơn không khí N2=28, còn được gọi là khí nitơ.
-
Ít tan trong nước (ở điều kiện thường 1 lít nước hòa tan 0,015 lít khí nitơ)
-
Nhiệt độ hóa lỏng ở mức -196 độ C và nhiệt độ hóa rắn cũng rất thấp. Nitơ lỏng là một hợp chất giống như nước, chỉ có 80,8% nitơ ở điểm sôi, hằng số điện môi là 1,4.
-
Không duy trì lửa và sự sống.
Tính chất hóa học của nitơ
Vậy những tính chất hóa học của nitơ là gì?

-
Nitơ là một liên kết ba rất mạnh , thậm chí ở 3000*C, nó không bị phân hủy đáng kể thành các nguyên tử.
-
Ở nhiệt độ phòng, Nitơ trơ về mặt hóa học nhưng trở nên hoạt động hơn và phản ứng với nhiều chất ở nhiệt độ cao.
-
Trong hợp chất cộng hoá trị của nitơ với các nguyên tố có độ âm điện nhỏ hơn (như hiđro, các kim loại…), nitơ có số oxi hoá -3.
-
Trong hợp chất cộng hóa trị của nitơ với các nguyên tố có độ âm điện lớn hơn (oxi, clo, flo) thì nitơ có số oxi hóa dương, từ +1 đến +5.
Như vậy, khi tham gia phản ứng oxi hóa – khử, nitơ có thể làm giảm hoặc tăng số oxi hóa. Vì lý do này, nitơ vừa là chất oxi hóa vừa là chất khử. Trong đó, tính oxi hóa là tính chất chính của N2.
Nitơ là chất oxi hóa
Với hầu hết các nguyên tố kim loại, nitơ sẽ phản ứng ở nhiệt độ cao, thể hiện tính oxi hóa khi giảm số oxi hóa từ 0 xuống -3 với các xúc tác là khí hiđro, nhiệt độ, áp suất. Trừ trường hợp tác dụng với Li (có thể tác dụng ở điều kiện bình thường).
Tác dụng với kim loại
Ở nhiệt độ cao, nitơ thể hiện tính oxi hóa khi phản ứng với một số kim loại có hoạt tính oxi hóa mạnh như Ca, Mg, Al… tạo thành nitrua kim loại.
Ví dụ:
3Mg + N2 → Mg3N2 (nhiệt độ)
0 -3
Phản ứng với hydro
Ở nhiệt độ cao, áp suất cao và có mặt chất xúc tác, nitơ có thể phản ứng trực tiếp với Hydro để tạo ra amoniac theo phương trình:
N2 + 3H2 → 2NH3 (nhiệt độ, P, xúc tác)
0 -3
Trong phản ứng này, nitơ thể hiện tính oxi hóa khi số oxi hóa giảm từ 0 đến -3.
Nitơ đang giảm
Ở nhiệt độ khoảng 3000 độ C (hoặc tiếp xúc với tia lửa điện), nitơ sẽ thể hiện tính khử khi kết hợp trực tiếp với oxi và tạo ra nitơ monooxit NO theo phương trình:
N2 + O2 → 2NO (nhiệt độ)
0 +2
Như vậy, nitơ thể hiện tính khử khi số oxi hóa tăng từ 0 lên +2. Chất này để ngoài không khí sẽ chuyển sang màu nâu đỏ tạo thành NO2.
Nitơ oxit là một nhóm hợp chất – sản phẩm tạo bởi hai nguyên tố N và O. Tùy theo cấu tạo mà chúng sẽ có những tính chất khác nhau và công dụng khác nhau. Ví dụ: N2O là khí gây cười, hại não, NO2 là chất gây ô nhiễm môi trường, được dùng trong y học hoặc dùng làm nguyên liệu chế tạo phân bón hóa học.
Cách điều chế nitơ?
Có nhiều cách để điều chế N2 nhưng dưới đây là một số phương pháp phổ biến nhất.

Điều chế nitơ trong phòng thí nghiệm
Trong phòng thí nghiệm, nitơ tinh khiết được điều chế bằng cách đun nóng nhẹ dung dịch muối amoni nitrit bão hòa (hoặc thay bằng amoni clorua và natri nitrit).
phương trình :
NH4NO2 → N2 (↑) + 2H2O (nhiệt độ)
NH4Cl + NaNO2 → N2 (↑) + NaCl + 2H2O (nhiệt độ)
Ngoài ra, để điều chế nitơ trong phòng thí nghiệm, người ta còn có thể đun nóng amoni đicromat (NH4)2Cr2O7 hoặc phân hủy nhiệt Natri Azit hoặc Bari Azit.
Sản xuất nitơ trong công nghiệp
Trong công nghiệp, nitơ được sản xuất bằng cách chưng cất phân đoạn không khí lỏng dưới áp suất cao và nhiệt độ cực thấp sau khi loại bỏ CO2 và hơi nước. Khi nâng nhiệt độ không khí lỏng lên -196 độ C, nitơ sẽ sôi và bị loại bỏ.

Ngoài ra, nitơ công nghiệp còn được điều chế bằng phương pháp cơ học là màng lọc, sử dụng áp suất (PSA).
Đây là hai trong số những cách điều chế N2 tạo ra nhiều sản phẩm nhất và tốn ít chi phí nhất có thể. Nitơ được vận chuyển trong một bình thép có áp suất nén 150atm.
Xem thêm:
- Điện phân là gì? Lý thuyết và bài tập chi tiết
- Phản ứng trao đổi ion: Điều kiện xảy ra phản ứng và viết phương trình ion thu gọn
Ứng dụng của nitơ trong đời sống và công nghiệp
Nitơ có vai trò gì trong cuộc sống của chúng ta? Khí Nitơ có ích hay có hại, cách sử dụng chúng? Cùng tìm hiểu ứng dụng của nitơ trong đời sống và công nghiệp ở 3 dạng: khí nitơ, hợp chất của nitơ và khí nitơ lỏng .

Ứng dụng của các hợp chất nitơ
Nitơ phân tử trong khí quyển tương đối trơ, nhưng trong tự nhiên, nó được chuyển đổi rất chậm thành các hợp chất hữu ích về mặt sinh học và công nghiệp. Sự kết hợp hoặc cố định nitơ là một tính năng quan trọng trong ngành công nghiệp hóa chất hiện đại. Nitơ được chuyển thành amoniac, có thể được sử dụng trực tiếp làm phân bón hoặc làm nguyên liệu thô cho nhiều hóa chất quan trọng như chất nổ và nhiên liệu tên lửa .
Ứng dụng của khí nitơ lỏng
Nitơ lỏng là gì? Nitơ lỏng là nitơ ở trạng thái lỏng, nhiệt độ cực thấp (khoảng -196 độ C), nó có thể phá hủy mọi thứ liên quan đến sự sống. Nó là một trong những loại khí công nghiệp và có ứng dụng rộng rãi.

Nitơ lỏng được sản xuất công nghiệp được biết đến như một chất làm lạnh có thể làm cứng các mô sống ngay lập tức khi tiếp xúc. Nó hoạt động như một chất làm đặc và như một chất mang nitơ dạng khí không nén được. Ngoài ra, nó có thể duy trì nhiệt độ một cách đáng kinh ngạc. Với khả năng bay hơi ở 77 K (-196°C hoặc -320°F), nitơ lỏng cực kỳ hữu ích trong nhiều ứng dụng, chẳng hạn như:
-
Làm lạnh thực phẩm trong quá trình vận chuyển.
-
Bảo quản mẫu, sinh phẩm (các cơ quan trong cơ thể hoặc tế bào tinh trùng, trứng…).
-
Được ứng dụng trong nhiều nghiên cứu về môi chất lạnh.
-
Minh họa trong giáo dục .
-
Loại bỏ các tổn thương da ác tính hoặc có khả năng gây ung thư (mụn cóc, vết chai trên da, v.v.)
-
Nguồn làm mát để tăng tốc CPU, GPU hoặc phần cứng khác.
Ứng dụng của khí nitơ
Nitơ dạng khí được sản xuất nhanh chóng bằng cách làm nóng và làm bay hơi nitơ lỏng. Khí này có nhiều ứng dụng phổ biến, chẳng hạn như:
-
Bảo quản độ tươi của thực phẩm đóng gói (bằng cách làm chậm quá trình oxy hóa).
-
Đảm bảo an toàn chất nổ lỏng .
-
Sản xuất linh kiện điện tử (như bóng bán dẫn, điốt và IC).
-
Sản xuất thép không gỉ, lốp bơm hơi ô tô, máy bay .
-
Được sử dụng như một chất thay thế ưu tiên cho carbon dioxide để tạo áp suất cho các thùng chứa của một số loại bia. Nó tạo ra ít bọt hơn, làm cho bia mịn và nặng hơn.
Bài tập nitơ SGK Hóa học 11 có lời giải chi tiết
Hãy cùng vận dụng những lý thuyết đã học chi tiết về nitơ ở các phần trên vào thực hành một số bài tập cơ bản SGK Hóa 11 dưới đây.

Giải bài 1 trang 31 SGK Hóa học 11
Mô tả cấu trúc của phân tử N2? Vì sao nitơ trơ ở điều kiện thường? Trong điều kiện nào nitơ trở nên hoạt động hơn?
Câu trả lời:
Cấu hình electron của nitơ: 1s22s22p3
CTCT của phân tử nitơ: NN
Giữa hai nguyên tử trong phân tử N2 hình thành liên kết ba bền vững. Mỗi nguyên tử nitơ trong phân tử N2 có 8 electron lớp ngoài cùng, trong đó có 3 electron dùng chung và 1 electron dùng riêng.
Ở điều kiện thường, nitơ rất trơ vì có liên kết ba bền vững giữa hai nguyên tử. Ở 3000 độ C, liên kết chưa bị phân hủy đáng kể thành nguyên tử.
Ở nhiệt độ cao, nitơ trở nên hoạt động do phân tử N2 bị phân hủy thành nguyên tử nitơ có 5e lớp ngoài cùng và độ âm điện tương đối lớn (3,04) nên trở nên hoạt động.
Giải bài 2 SGK Hóa 11 trang 31
Nitơ không duy trì hô hấp, Nitơ có phải là khí độc không?
Giải: Nitơ không phải là khí độc, mặc dù nó không duy trì sự sống và sự cháy.
Giải bài 3 SGK trang 31 Hóa học 11
một. Tìm các cặp công thức đúng của liti nitrua và nhôm nitrua:
A. LiN3 và Al3N
B. Li3N và AlN
C. Li2N3 và Al2N3
D. Li3N2 và Al3N2
b. Viết phương trình hóa học của phản ứng tạo thành liti nitrua và nhôm nitrua khi cho liti và nhôm phản ứng trực tiếp với nitơ. Trong các phản ứng này nitơ là chất oxi hóa hay chất khử?
Câu trả lời:
một. Câu trả lời là không
Khi liên kết với kim loại, nitơ dễ dàng nhận 3e (Nitơ có 5e ở lớp ngoài cùng nên có số oxi hóa -3, còn Li dễ nhường 1e và Al dễ nhường 3e nên có số oxi hóa +1 và +3), tương ứng. .
b.
6Li + N2 → 2Li3N
0 0 +1 -3
2Al + N2 → 2AlN
0 0 +3 -3
Ta thấy trong các phản ứng trên, nitơ là chất oxi hóa vì:
N2 + 6e → 2N
0 -3
Giải bài 4 trang 31 SGK Hóa học 11
Số oxi hóa của nguyên tố nitơ trong các hợp chất sau: NO, NO2, NH3, NH4Cl, N2O, N2O3, N2O5, Mg3N2 là bao nhiêu?
Câu trả lời:
Trong các hợp chất trên, số oxi hóa của nitơ lần lượt là: +2, +4, -3, -3, +1, +3, +5, -3.
Giải bài 5 SGK Hóa 11 trang 31
Cần bao nhiêu lít nitơ và hiđro để tạo thành 67,2 lít khí amoniac? Cho biết thể tích các khí ở đktc đo ở cùng điều kiện nhiệt độ, áp suất và hiệu suất của phản ứng là 25%?
Câu trả lời:
Ta thấy tỉ lệ về thể tích bằng tỉ lệ về số mol:
N2 + 3H2 → 2NH3 (P, nhiệt độ, xúc tác)
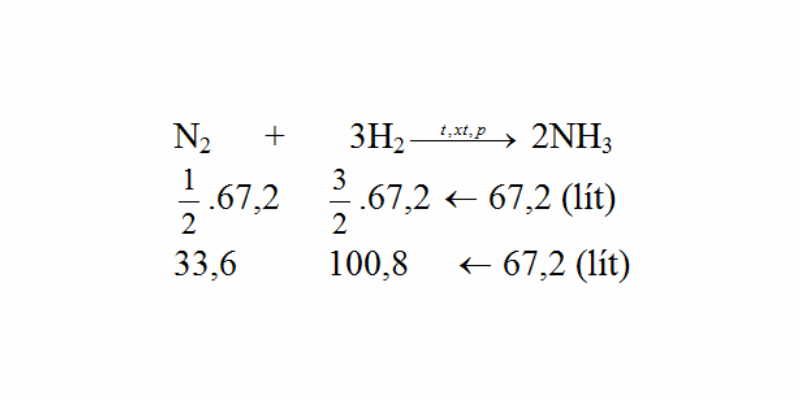
Tỉ lệ mol cũng chính là tỉ lệ thể tích
Theo phương trình:
V(N2) = 1/2 x V(NH3) = 1/2 x 67,2 = 33,6lít
V(H2) = 3/2 V(NH3) = 3/2 x 67,2 x 100,8lit
Vì hiệu suất của phản ứng là 25% nên thể tích nitơ và hiđro cần dùng là:
V(N2) = 33,6 x 100/25 = 134,4 lít
V(H2) = 100,8 x 100/25 = 403,2 lít
Như vậy, bài viết trên đã giúp bạn đọc có thêm những kiến thức cơ bản về nitơ bao gồm: Nito là gì, tính chất vật lý hóa học, ứng dụng và điều chế nitơ. manta.edu.vn hy vọng những thông tin này sẽ hữu ích cho quá trình học tập của các bạn. Đừng quên truy cập website manta.edu.vn mỗi ngày để nhận thêm nhiều bài học hay về Toán, Lý, Hóa các cấp nhé!



