Ancol hay còn được gọi với cái tên quen thuộc là cồn, là một trong những hợp chất hữu cơ quan trọng nhất. Để có thể làm thành thạo các dạng bài tập liên quan đến Ancol, dưới đây là những kiến thức cơ bản và đầy đủ nhất về Ancol.
Định nghĩa của Ancol là gì? Ancol bao gồm những loại nào?
Ancol là hợp chất hữu cơ mà phân tử có nhóm hiđroxyl (-OH) liên kết trực tiếp với nguyên tử cacbon no, có công thức R(OH)n.
Ví dụ: CH2=CHCH2OH, C6H5CH2OH, CH3OH, C2H5OH, v.v.
Công thức chung của ancol có các dạng chính sau:
-
CxHyOz (Điều kiện: x, y, z là các số tự nhiên; y chẵn và 4 ≤ y ≤ 2x + 2; z ≤ x). Công thức này được sử dụng khi viết phản ứng đốt cháy.
-
CxHy(OH)z hoặc R(OH)z: Dùng khi viết phản ứng xảy ra ở nhóm OH.
-
CnH2n+2-2k-z(OH)z (Điều kiện: k = số liên kết proton + số vòng; n, z là các số tự nhiên; z ≤ n). Công thức này thường dùng để viết phản ứng cộng Br2, cộng H2, khi biết số chức; đầy đủ hay không đầy đủ…
-
CnH2n+1OH hoặc CnH2n+2O (n ≥ 1): Công thức chung của ancol no, đơn chức, mạch hở.
Ancol bao gồm những loại nào?
-
Theo gốc hiđrocacbon : Ancol được phân thành ancol no, ancol không no, ancol thơm.
-
Theo số nhóm hiđroxyl : Ancol được chia thành ancol đơn chức và ancol đa chức.
-
Bậc của ancol = bậc của nguyên tử C liên kết với nhóm -OH.
Một số loại Ancol tiêu biểu mà chúng ta có thể kể đến như:
-
Ancol no, đơn chức, mạch hở : Phân tử có nhóm “-OH” gắn với gốc ankyl (CnH2n+1-OH).
Ví dụ: CH3-OH, C3H7-OH, v.v.
-
Ancol no, không no, mạch hở: Phân tử có nhóm –OH liên kết với gốc cacbon no của hiđrocacbon không no.
Ví dụ: CH3-CH=CH-CH2-OH, CH2=CH-CH2-OH, v.v.
-
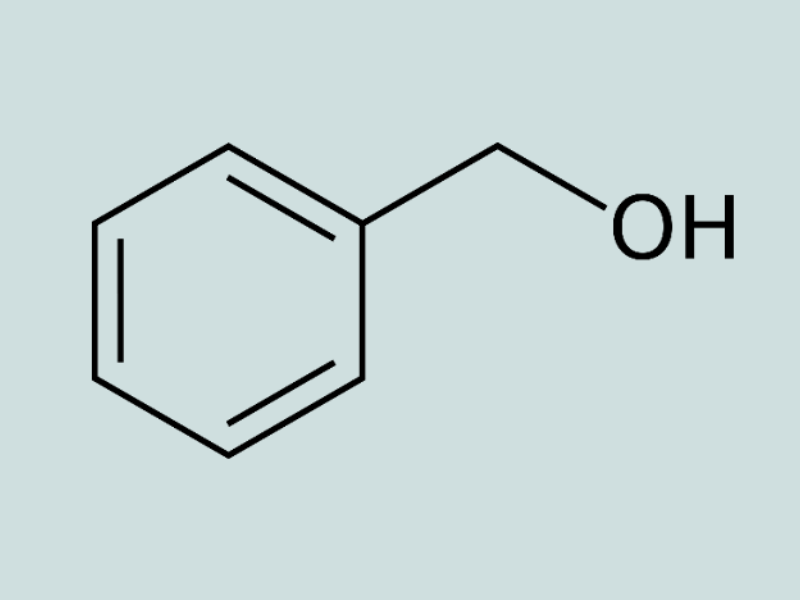
Ancol thơm, đơn chức : Phân tử có nhánh “-OH” liên kết với nguyên tử cacbon no của mạch nhánh của vòng benzen.
Ví dụ:
-
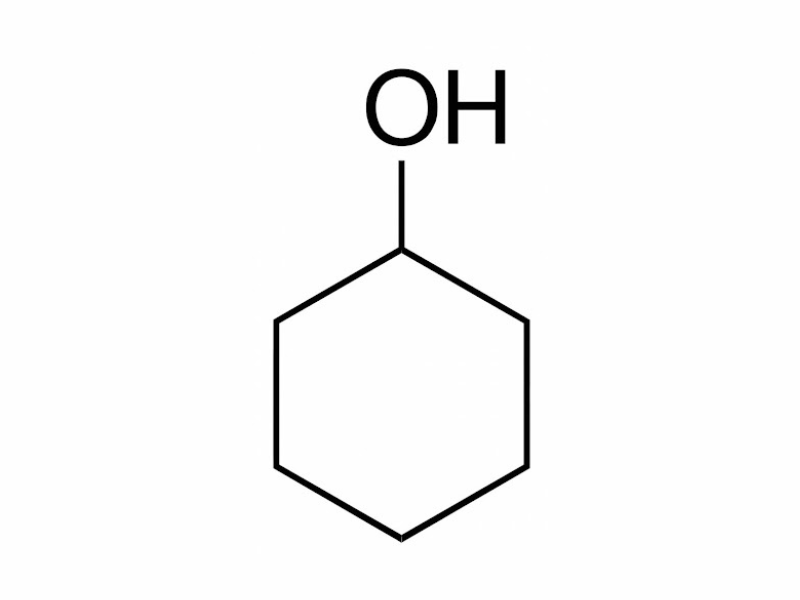
Ancol no mạch hở, đơn chức: Phân tử ancol có chứa nhóm “-OH” liên kết với nguyên tử cacbon no của gốc hiđrocacbon no.
Ví dụ:
-
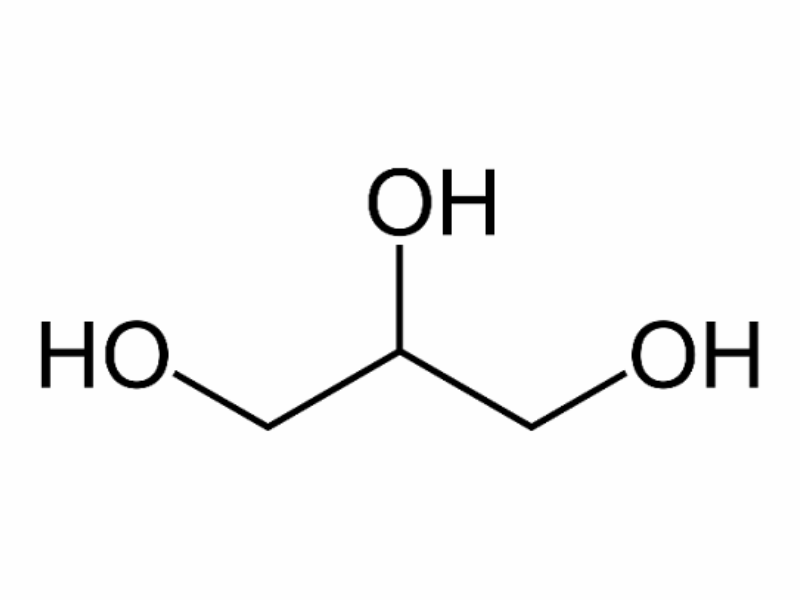
Ancol đa chức : Phân tử chứa hai hay nhiều nhóm ancol “-OH”. Tùy theo thứ tự của các nguyên tử cacbon no liên kết với nhóm -OH mà các ancol này được chia thành: ancol bậc một, ancol bậc hai và ancol bậc ba.
Ví dụ:
Đồng phân và danh pháp của Ancol
Trước khi tìm hiểu tính chất của ancol , chúng ta hãy tìm hiểu về đồng phân và cách gọi tên chúng.
Đồng phân của Ancol
Ancol no, mạch hở, đơn chức có đồng phân cấu tạo về mạch cacbon và đồng phân vị trí nhóm chức -OH trong mạch cacbon. Ngoài ra, Ancol đơn chức có đồng phân là ete: RO-R’.
Ví dụ:
Viết các đồng phân của C4H10O, ta có:
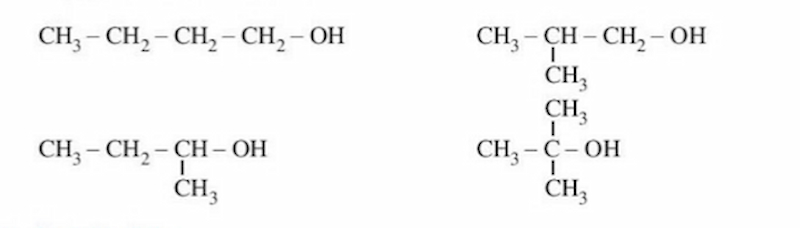
Ví dụ viết đồng phân của C3H8O, ta có:
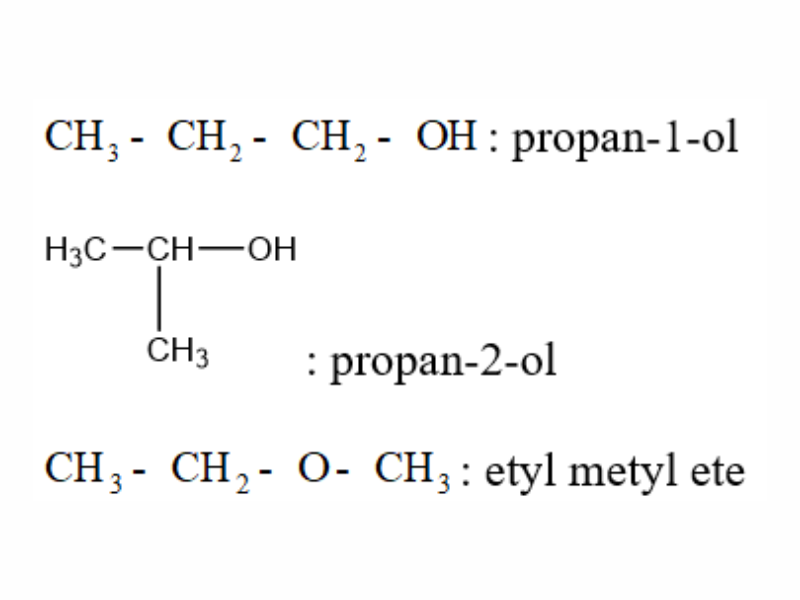
Danh pháp Ancol
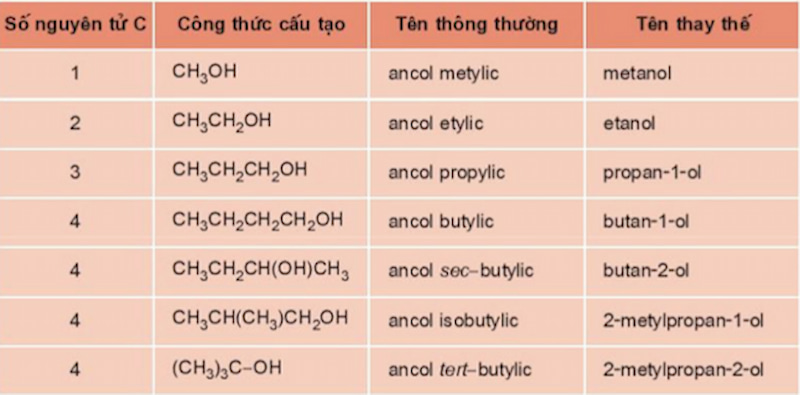
Cách gọi tên các Ancol như sau:
Tên thông thường = Alcohol (Ancol) + Tên gốc alkyl + ic
Ví dụ:
CH3-CH2-OH: Ancol etylic.
CH3-OH: Ancol metylic.
Ngoài ra, dưới đây là một số loại Ancol có tên đặc biệt bạn cần chú ý:
-
CH2OH-CH2OH: Etilenglicol
-
CH2OH-CHOH-CH2OH: Glycerin hay còn gọi là Glycerol
-
CH3-CH(CH)3-CH2-CH2OH: Ancol isoamylic
Tên thay thế = Tên hiđrocacbon tương ứng + Chỉ số chức OH + ol .
Phía trong:
-
Chuỗi chính của Ancol là chuỗi carbon dài nhất liên kết với nhóm -OH.
-
Các nguyên tử cacbon được đánh số từ phía gần nhóm -OH hơn.
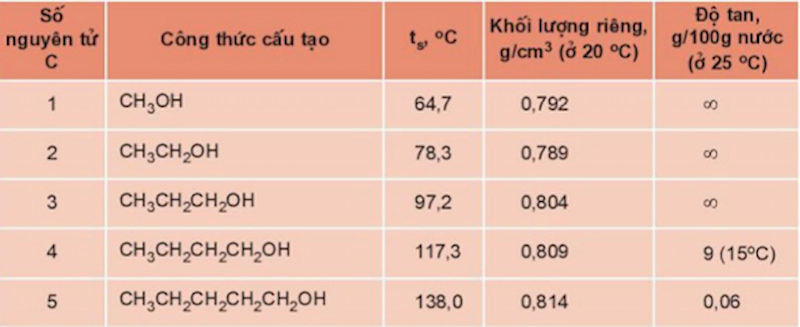
Tính chất vật lý của ancol
Dưới đây là những tính chất vật lý nổi bật của Ancol mà bạn cần biết.
-
Trạng thái tồn tại : Hầu hết các Ancol ở trạng thái lỏng và rắn tùy thuộc vào số lượng phân tử carbon trong công thức. Từ C1 đến C12, Ancol tồn tại ở thể lỏng và từ C13 trở lên là thể rắn.
-
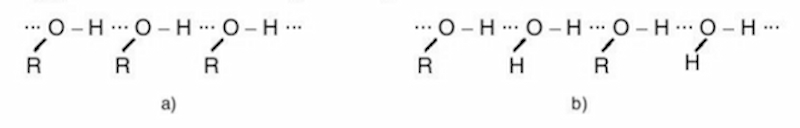
Nhiệt độ sôi : Nhiệt độ sôi của ancol cao hơn các hiđrocacbon có cùng phân tử khối vì chúng có liên kết hiđro liên phân tử. Khi so sánh với các chất có khối lượng phân tử tương tự, nhiệt độ sôi của các hợp chất là: Muối > Axit > Ancol > Andehit > Hydrocacbon, Ether hoặc Este, v.v.
-
Tính tan: Các ancol có 1, 2 hoặc 3 nguyên tử C trong phân tử sẽ tan vô hạn trong nước. Ancol có càng nhiều C thì độ tan trong nước càng giảm vì tính kị nước của gốc hiđrocacbon tăng.
-
Nhiệt độ sôi, khối lượng riêng của ancol tăng khi khối lượng phân tử tăng, độ tan trong nước giảm.
Tính chất hóa học của ancol
Trong phân tử, liên kết C – OH, đặc biệt là liên kết phân cực mạnh, nhóm -OH, đặc biệt là nguyên tử H sẽ dễ bị thay thế hoặc tách ra trong các phản ứng hóa học. Đây là yếu tố mang lại những tính chất hóa học quan trọng của ancol .

Phản ứng thế H của OH . tập đoàn
Phản ứng thế H của nhóm OH là một trong những tính chất hóa học nổi bật nhất của ancol .
Tính chất chung của ancol
Thí nghiệm : Cho một mẫu natri kim loại vào ống nghiệm chứa 1-2ml etanol khan rồi phản ứng giải phóng khí hiđro.
Phương trình : 2C2H5OH + 2Na → 2C2H50Na + H2
Hiện tượng: Đốt cháy hết khí Hiđro ở đầu ống ta quan sát thấy ngọn lửa màu xanh nhạt xuất hiện: 2H2 + O2 → 2H2O (nhiệt độ)
Kết luận: Ancol tác dụng được với kim loại kiềm.
Tính chất đặc trưng của glixerol
Thí nghiệm:
Bước 1: Cho vào hai ống nghiệm, mỗi ống chứa 3-4 giọt dung dịch CuSO4 2% và 2-3ml dung dịch NaOH 10%, lắc nhẹ dung dịch thu được. Ở cả 2 ống nghiệm đều xuất hiện kết tủa Cu(OH)2 màu xanh lam:
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
Bước 2: Tiếp tục nhỏ 3-4 giọt Ethanol ở ống thứ nhất, 3-4 giọt Glycerol ở ống thứ hai, lắc nhẹ cả 2 ống nghiệm. Ở ống 1 xuất hiện kết tủa không tan và ở ống 2 xuất hiện kết tủa màu xanh lam của muối đồng(II) glixerol.
2C3H5(OH)3 + Cu(OH)2 → [(C3H5(OH)2O]2Cu + 2H2O
Kết luận: Như vậy glixerol hòa tan được đồng(II) hiđroxit tạo thành dung dịch có màu xanh mà etanol không có. Phản ứng này giúp phân biệt ancol đơn chức với ancol đa chức có các nhóm -OH liền kề nhau trong phân tử.
OH . phản ứng thế nhóm
Tính chất “thay thế nhóm OH” của ancol được thể hiện qua: Phản ứng với axit vô cơ và phản ứng với ancol.
Phản ứng với axit vô cơ
Thí nghiệm: Khi đun nóng hỗn hợp axit bromhidric và etanol trong ống nghiệm có ống dẫn khí trên nhánh thì thu được chất lỏng không màu, nặng hơn nước. Đây là Etyl Bromua: C2H5OH + HBr → C2H5Br + H2O
Như vậy Ancol phản ứng với axit vô cơ HX (Alcol + H2SO4, Ancol + HCl) theo công thức:
CnH(2n+2-2k-z)(OH)z + (z+k)HX → CnH(2n+2-z)X(z+k)
Trong đó: Số khối của nguyên tử X sẽ bằng tổng số nhóm OH và số liên kết pi.
Ngoài ra, Ancol phản ứng với axit hữu cơ, được gọi là phản ứng este hóa.
ROH +R’COOH R’COOR + H2O
yR(OH)x + xR'(COOH)y ⇔ R’x(COO)xyRy + xyH2O
Chú ý:
-
Phản ứng chỉ thực hiện trong môi trường axit và đun nóng.
-
Cần chú ý đến sự chuyển dịch cân bằng vì phản ứng là thuận nghịch.
Phản ứng với Ancol
Thí nghiệm: Cho 1ml Ethanol vào ống nghiệm khô, thêm từ từ 1ml axit H2SO4 đặc và lắc đều. Sau đó đun sôi nhẹ hỗn hợp và nhấc ống nghiệm ra khỏi ngọn lửa. Cho từ từ từng giọt etanol dọc theo ống nghiệm vào hỗn hợp đang cháy, quan sát thấy mùi đặc trưng của ete etylic.
Phương trình: C2H5 – OH + H – OC2H5 → C2H5 – O – C2H5 + H2O (H2SO4, 140 độ C)
Phản ứng tách nước
Khi đun ancol etylic với axit H2SO4 đặc đến nhiệt độ khoảng 170 độ C ta thu được khí etilen.
Phương trình: CH3 – CH2 – OH → CH2 = CH2 + H2O (H2SO4, 170 độ C)
Tính chất này được dùng để điều chế etilen trong phòng thí nghiệm.
Cũng ở điều kiện trên, các ancol no đơn chức mạch hở (trừ Methanol) có thể bị khử nước tạo thành Anken.
CnH(2n+1)OH → CnH2n + H2O (H2SO4, nhiệt độ)
Ancol no, đơn chức, mạch hở sẽ tách nước từ một phân tử để tạo thành anken:
CnH2n+1OH = CnH2n + H2O (H2SO4 đặc, >170 độ C)
-
Điều kiện khi tham gia phản ứng này là phải có Hg.
-
Nếu một ancol no, đơn chức mạch hở không tách nước tạo thành anken thì ancol đó không có Ha (có phải là CH3OH hay là ancol mà nguyên tử C liên kết với OH chỉ liên kết với C bậc ba khác).
-
Nếu một ancol tách nước cho hỗn hợp nhiều anken thì đó là ancol bậc cao như bậc hai, bậc ba và mạch C bất đối xứng về liên kết C OH.
-
Khi nhiều ancol tách nước tạo anken thì có các khả năng sau xảy ra:
Phản ứng khử nước đặc biệt:
CH2OH-CH2OH → CH3CHO + H2O
CH2OH-CHOH-CH2OH → CH2=CH-CHO + 2H2O
Tách nước từ 2 phân tử ancol tạo thành ete
ROH + ROH → ROR + H2O (H2SO4 đặc, 140 độ C)
Chú ý:
-
Từ n ancol khác nhau tách nước ta được n.(n + 1)/2 ete. Trong số đó có n ete đối xứng.
-
Khi tách nước thu được ete có số mol bằng nhau thì ancol tham gia phản ứng sẽ có số mol bằng nhau và nAncol = 2.nete = 2.nH2O và nAncol = meth + nH2O + mAncol dư.
phản ứng oxy hóa
Phản ứng oxi hóa cũng là một trong những tính chất hóa học quan trọng của ancol với:
-
Phản ứng oxi hóa không hoàn toàn (Alcol + CuO hoặc Oxi do Cu xúc tác)
Ancol bậc 1 + Cuo tạo anđehit: RCH2OH + CuORCHO + Cu + H2O
Ancol bậc hai + CuO tạo xeton: RCHOHR’ + CuO – RCOR’ + Cu + H2O
Ancol bậc 3 không bị oxi hóa bởi CuO.
Chú ý: mkhử khử = mCuO phản ứng – mCu tạo thành = 16.nAncol đơn chức
-
Phản ứng oxi hóa hoàn toàn
CxHyOz + (x + y/4 – z/2)O2 → xCO2 + y/2H2O
Trong quá trình oxi hóa hoàn toàn ancol ta cần lưu ý:
Phản ứng đốt cháy ancol có đặc điểm giống phản ứng đốt cháy hiđrocacbon tương ứng.
Nếu đốt cháy Ancol mà nH2O > nCO2 thì Ancol cháy là Ancol no và nAncol = nH2O–nCO2.
Nếu đốt cháy ancol cho nH2O > 1,5.nCO2 thì ancol đem đốt là CH3OH. Chỉ có CH4 và CH3OH có tính chất này (không kể amin).
Khi đốt cháy hợp chất hữu cơ X mà nH2O > nCO2 thu được chất đó là ankan mạch hở, ancol no hoặc ete no mạch hở có cùng công thức CnH2n+2O4.
2 phương pháp điều chế Ancol
Ancol được làm như thế nào? Hãy cùng manta.edu.vn tìm hiểu 2 phương pháp pha chế Ancol cơ bản.
phương pháp tiếp cận tích hợp
Được sử dụng ở nhiều nước công nghiệp, etanol thu được bằng cách tổng hợp etylen với nước có xúc tác phản ứng H2SO4 hoặc H3PO4 ở nhiệt độ cao:
C2H4 + H2O → C2H5-OH (H2SO4, nhiệt độ)
Ngoài ra người ta còn tổng hợp ancol bằng cách thuỷ phân dẫn xuất halogen trong dung dịch kiềm.
Tổng hợp glycerol từ propile
Glyxerol được điều chế từ propile theo sơ đồ:
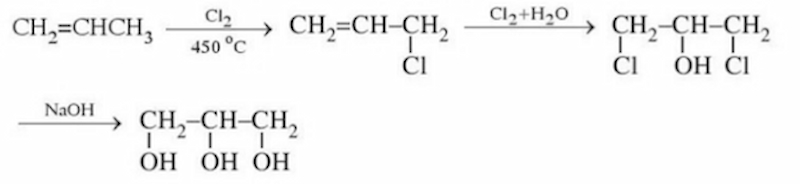
Ngoài ra, glixerol còn thu được từ quá trình thủy phân chất béo trong quá trình xà phòng hóa chất béo.
phương pháp sinh hóa
Ethanol còn được thu nhận thông qua quá trình lên men từ các loại nông sản chứa nhiều tinh bột như gạo, ngô, khoai, sắn, quả chín… Theo sơ đồ:
(C6H10O5)n → C6H12O6 (H2O, nhiệt độ, xúc tác) → C2H5OH (xúc tác enzym)
Ứng dụng của Ancol
Với những tính chất lý hóa như trên, cồn sở hữu nhiều ứng dụng quan trọng trong công nghiệp thực phẩm (Ancol, nước giải khát), y tế (dung môi, dược phẩm…), động cơ (nhiên liệu ô tô)…
Bài tập về ancol SGK Hóa 11 có lời giải chi tiết
Hãy cùng vận dụng những lý thuyết cơ bản trên để thực hành giải một số bài tập Hóa học cơ bản trong SGK Hóa học 11 về ancol sau đây nhé!

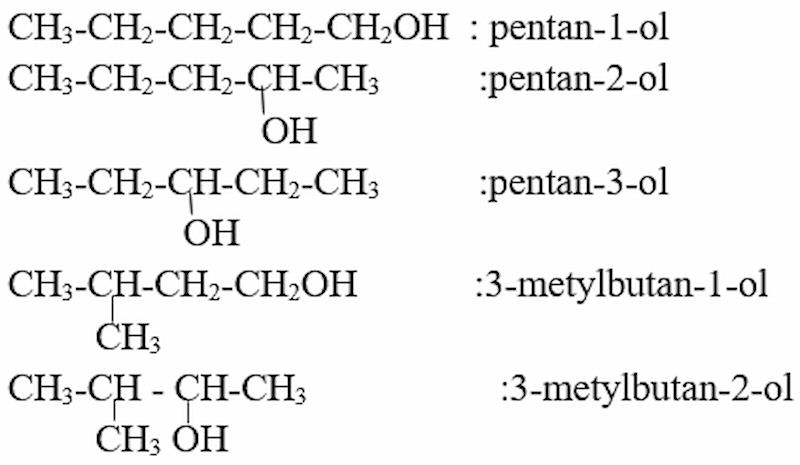
Giải bài 1 trang 186 SGK Hóa học 11
Viết công thức cấu tạo và gọi tên các ancol đồng phân có công thức phân tử C5H12O?
Câu trả lời gợi ý:
Công thức cấu tạo và đặt tên:
Giải bài 2 SGK Hóa 11 trang 186
Viết phương trình hóa học của phản ứng propan-1-ol với mỗi chất sau:
một. natri kim loại.
b. CuO nung nóng
c. Axit HBr, với chất xúc tác
Trong mỗi phản ứng, ancol đóng vai trò gì: chất khử, chất oxi hóa, axit, bazơ? Giải thích.
Câu trả lời gợi ý:
a) 2CH3-CH2-CH2OH + 2Na → 2CH3-CH2-CH2ONa + H2↑
Ancol đóng vai trò là chất oxi hóa
b) CH3-CH2-CH2OH + CuO → CH3-CH2-CHO + Cu + H2O
Ancol đóng vai trò là chất khử
c) CH3-CH2-CH2OH + HBr → CH3-CH2-CH2Br + H2O
Ancol đóng vai trò như một cơ sở
Giải bài 3 SGK trang 186 Hóa học 11
Nêu phương pháp hóa học phân biệt các chất lỏng đựng trong các lọ không dán nhãn: etanol, glixerol, nước, benzen.
Câu trả lời gợi ý:
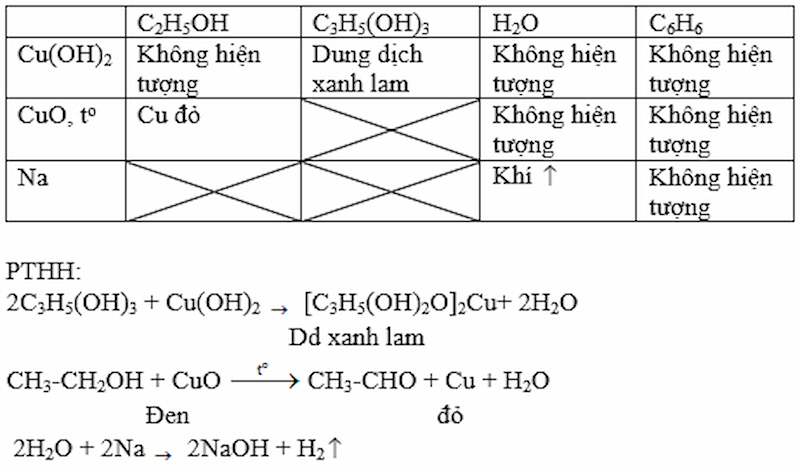
Giải bài 4 trang 186 SGK Hóa 11
Từ propen và các chất vô cơ cần thiết có thể điều chế các chất sau: propan-2-ol (1); propan-1,2-điol (2). Viết các phương trình hóa học cho phản ứng xảy ra.
Câu trả lời gợi ý:
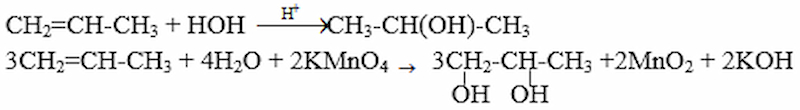
Giải bài 5 SGK Hóa 11 trang 187
Cho 12,20 gam hỗn hợp X gồm etanol và propan-1-ol phản ứng hết với Na (dư) thu được 2,80 lít khí đkc.
một. Tính thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp X?
b. Cho hỗn hợp X đi qua bình đựng CuO và nung nóng. Viết các phương trình hóa học cho phản ứng xảy ra.
Câu trả lời gợi ý:
a) Gọi số mol của etanol và propan-1-ol lần lượt là x và y (mol).
Phương trình phản ứng:

b) Phương trình phản ứng:
CH3-CH2OH + CuO → CH3-CHO + Cu + H2O (Điều kiện: Nhiệt độ)
CH3-CH2-CH2OH + CuO → CH3-CH2-CHO + Cu + H2O (Điều kiện: Nhiệt độ)
Trên đây là những kiến thức cơ bản và quan trọng nhất mà bạn cần lưu ý khi tìm hiểu về Ancol. Hi vọng bài viết này sẽ giúp các bạn nắm vững những thông tin về loại hợp chất hữu cơ thông dụng này, từ đó vận dụng thành thạo vào các bài tập Hóa học cũng như trong đời sống. Chúc các bạn có quá trình học tập hiệu quả và đừng quên truy cập website manta.edu.vn mỗi ngày để cập nhật thêm nhiều bài học bổ ích nhé.



